题目内容
6.烟气脱硫能有效减少二氧化硫的排放.其研究性学习小组在实验室利用下列装置制备模拟烟气(主要成分SO2、CO2、N2、O2),并测定烟气中SO2的体积分数以及研究通过转化器的脱硫效率:
回答下列问题:
1.模拟烟气的制备
(1)写出装置A中发生化学反应的化学方程式C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H2O;检查装置A气密性的方法是向分液漏斗中注入蒸馏水后,关闭止水夹,打开分液漏斗下端活塞使液体流下,一段时间后,液体不能继续滴下,证明气密性良好.
2.测定烟气中SO2的体积分数
(2)欲测定烟气中SO2的体积分数,则装置按气流方向的接口顺序为abcedf.
(3)①甲同学认为应该在装置C、D(填字母)之间增加一个盛有品红溶液的洗气瓶,理由是检验是否被完全吸收.
②在准确读取量筒读数之前冷却至室温、并上下移动量筒使得量筒液面与广口瓶液面相平.
(4)乙同学根据模拟烟气的流速,(amL/min)和t min后量筒内液体的体积(V mL)测得二氧化硫的体积分数,其结果总是偏大,原因可能是模拟烟气中的氧气与溶解在水中的反应.
3.模拟烟气通过转化器的脱硫效率研究
(5)将模拟烟气通过装置F,其中盛有FeCl2,FeCl3的混合溶液,它可以催化SO2与氧气的反应以达到脱硫的目的.
①写出催化剂参与反应过程中的离子方程式:SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+;4Fe2++O2+4H+=2H2O+4Fe3+.
②丙同学在此实验过程中发现黄色溶液先变成红棕色,查阅资料得Fe3++6SO2=[Fe(SO2)6]3+(红棕色),请用化学平衡移动原理解释实验中溶液颜色变化的原因:平衡向右移动,溶液由黄色变为红棕色.
分析 1.模拟烟气的制备
(1)装置A中是浓硫酸和碳加热反应出二氧化碳、二氧化硫和水;检验装置A气密性先密闭装置,在分液漏斗中加入水,观察水是否流下判断气密性;
2.测定烟气中SO2的体积分数
(2)装置A按照碳和浓硫酸加热反应生成二氧化硫、二氧化碳和水,通过装置B模拟烟气,进入装置C检验和吸收二氧化硫气体,进入装置D,导气管短进长出,排碳酸氢钠溶液进入装置E测定二氧化碳体积,据此计算测定烟气中SO2的体积分数;
(3)①装置C除去二氧化硫是否完全,上述实验装置不能判断,需要增加一个验证二氧化硫是否除净的装置,增加一个盛有品红溶液的洗气瓶;
②排液法测定气体体积需要我的冷却到室温,且两边液面相平;
(4)乙同学根据模拟烟气的流速,(amL/min)和t min后量筒内液体的体积(V mL)测得二氧化硫的体积分数,其结果总是偏大可能是二氧化硫和溶解在水中的氧气氧化;
3.模拟烟气通过转化器的脱硫效率研究
(5)①催化剂通过参与反应改变反应的历程加快反应速率,本身在反应前后无论质量还是数量都不变;
②Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快,铁离子氧化二氧化硫反应缓慢,但是反应限度较大,使溶液中Fe3+浓度降低,生成Fe(SO2)63+的平衡逆向移动.
解答 解:(1)装置A中是浓硫酸和碳加热反应出二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H2O,检验装置A气密性先密闭装置方法为:向分液漏斗中注入蒸馏水后,关闭止水夹,打开分液漏斗下端活塞使液体流下,一段时间后,液体不能继续滴下,证明气密性良好,
故答案为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H2O;向分液漏斗中注入蒸馏水后,关闭止水夹,打开分液漏斗下端活塞使液体流下,一段时间后,液体不能继续滴下,证明气密性良好;
(2)装置A按照碳和浓硫酸加热反应生成二氧化硫、二氧化碳和水,通过装置B模拟烟气,进入装置C检验和吸收二氧化硫气体,进入装置D,导气管短进长出,排碳酸氢钠溶液进入装置E测定二氧化碳体积,据此计算测定烟气中SO2的体积分数,则装置按气流方向的接口顺序为abcedf,
故答案为:bcedf;
(3)①应该在装置CD之间增加一个盛有品红溶液的洗气瓶,检验二氧化硫是否除净,
故答案为:C、D;检验是否被完全吸收;
②在准确读取量筒读数之前冷却至室温、并上下移动量筒使得量筒液面与广口瓶液面相平.
故答案为:冷却至室温;
(4)乙同学根据模拟烟气的流速,(amL/min)和t min后量筒内液体的体积(V mL)测得二氧化硫的体积分数,其结果总是偏大,原因可能是模拟烟气中的氧气与溶解在水中的二氧化硫反应,
故答案为:模拟烟气中的氧气与溶解在水中的二氧化硫反应;
3.模拟烟气通过转化器的脱硫效率研究
(5)①SO2+2H2O+2Fe3+═SO42-+2Fe2++4H+ 在反应①中三价铁离子被还原为二价铁离子,要想保持质量、性质不变,得到的二价铁离子应该被氧气氧化为三价铁离子,反应的方程式为:4Fe2++O2+4H+=2H2O+4Fe3+,
故答案为:SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+;4Fe2++O2+4H+=2H2O+4Fe3+;
②Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2?Fe(SO2)63+,平衡向右移动,溶液由黄色变为红棕色,
故答案为:平衡向右移动,溶液由黄色变为红棕色.
点评 本题一道实验题,借助二氧化硫的污染治理情境,考查了气体制备原理,实验装置的选择,二氧化硫的性质及相关计算,题目综合性强,难度中等,注意在学习过程中注意培养分析问题,解决问题的能力.

| A. | 生石灰 | B. | 无水乙醇 | C. | 浓硫酸 | D. | 固体硝酸铵 |
| A. | 12753I和13153I是质子数相同的同种核素 | |
| B. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 | |
| C. | 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| A. | 加入过量氨水:Fe3+、NH4+、SO42-、OH- | |
| B. | 加入过量NaClO溶液:Fe2+、H+、Cu2+、SO42- | |
| C. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| D. | 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3- |
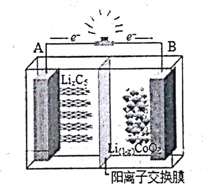 如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )| A. | 放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+Li+ | |
| B. | 充电时,A极发生氧化反应 | |
| C. | 充电时,Li+穿过隔离膜向B极移动 | |
| D. | 当B极失去xmol电子,电池消1molLiCoO2 |
| A. | 地沟油经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 | |
| C. | 采用纳米TiO2光触媒技术,可将装修材料中释放的HCHO转化为无害物质 | |
| D. | 神舟十一号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅晶体 |