题目内容
20.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.下图是工业上用制作印刷电路银板的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:(已知:滤液①和滤液②中溶质相同)
根据以上信息回答下列问题:
(1)写出生产过程中加入的试剂的名称:X铁粉,Y稀盐酸.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下
| 平行实验次数 | 1 | 2 | 3 | 4 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 25.35 | 24.05 | 23.95 | 24.00 |
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜,
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(3)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为1:1;
(4)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(5)依据图表CuCl产率可知PH=2产率最大,当pH较大时CuCl产率变低,Cu2+水解程度增大,生成的氯化亚铜少;
(6)依据方程式中各反应物量之间的关系计算CuCl的纯度,CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,CuCl~Ce4+,所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去.
解答 解:(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
故答案为:铁粉;稀盐酸;
(2)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒其方程式为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(3)依据图示可知:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体;
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
故答案为:防止CuCl的氧化和见光分解,减少产品CuCl的损失;
(5)依据图表CuCl产率可知pH=2产率最大为90%,当pH较大时CuCl产率变低,Cu2+水解程度增大,生成的氯化亚铜少;
故答案为:2;pH较大时,Cu2+水解程度增大,反应生成CuCl减少,产率减小;
(6)根据题目中所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去,滴定0.25g样品消耗硫酸铈标准溶液的平均体积=$\frac{24.05+23.95+24.00}{3}$=24mL,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,
CuCl~Ce4+,
CuCl的纯度=$\frac{24×1{0}^{-3}×0.1×99.5}{0.25}$×100%=95.5%;
故答案为:95.5%.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、物质的分离等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


| A. | 图 1 表示 H2与O2发生反应过程中的能量变化,则H2的燃烧热为 241.8kJ•mol-1 | |
| B. | 图 2 表示压强对可逆反应 2A(g)+2B (g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图 3 表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图 4 表示常温下,稀释 HA、HB 两种酸的稀溶液时,溶液 pH 随加水量的变化,则相同条件下 NaA溶液的 pH 大于同浓度的 NaB 溶液的 pH. |

| A. | 由水杨酸制冬青油的反应是取代反应 | |
| B. | 阿司匹林的分子式为C9H8O4,水解可得水杨酸 | |
| C. | 冬青油苯环上的一氯取代物有4种 | |
| D. | 可用NaOH溶液除去冬青油中少量的水杨酸 |
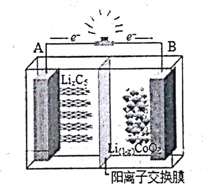 如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )
如下图为摇摆电池(Rocking chair battery)的工作原理图,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为:LiCoO2+6C$?_{放电}^{充电}$Li(1-x)CoO2+LixC6,下列有关说法正确的是( )| A. | 放电时,负极反应LiCoO2-xe-═Li(1-x)CoO2+Li+ | |
| B. | 充电时,A极发生氧化反应 | |
| C. | 充电时,Li+穿过隔离膜向B极移动 | |
| D. | 当B极失去xmol电子,电池消1molLiCoO2 |
| A. | H2C2O4是氧化剂 | |
| B. | KClO3是还原剂 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应有2mol电子转移 |
 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属.
已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属. .
.
 3-甲基戊烷
3-甲基戊烷 2,2-二甲基-3-乙基戊烷.
2,2-二甲基-3-乙基戊烷.