题目内容
10.对于反应:2H2S+SO2═3S+2H2O,被氧化的硫原子与被还原的硫原子的质量之比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:2 |
分析 反应:2H2S+SO2=3S↓+2H2O中,H2S中S元素的化合价升高,被氧化,SO2中S元素的化合价降低,被还原,结合方程式的化学计量数关系进行判断.
解答 解:应:2H2S+SO2=3S↓+2H2O中,H2S中S元素的化合价升高,被氧化,SO2中S元素的化合价降低,被还原,
由方程式计量数关系可知,
当有2molH2S被氧化时,有1molSO2被还原,
则被氧化与被还原的硫原子数之比为2:1,被氧化的硫原子与被还原的硫原子的质量之比为2:1,故选B.
点评 本题考查氧化还原反应的计算,题目难度不大,本题注意把握元素的化合价的变化,结合化学方程式计算即可.

练习册系列答案
相关题目
17.下列物质不可能是烯烃加成产物的是( )
| A. | CH2ClCH3 | B. | CH3CH3 | C. |  | D. |  |
5.区分晶体和非晶体最可靠的科学方法是( )
| A. | 观察外观是否规则 | B. | 测定是否有固定的熔点 | ||
| C. | 进行X射线衍射实验 | D. | 验证是否有各向异性 |
15.下列关于元素周期表的叙述中正确的是( )
| A. | 副族元素中没有非金属元素 | |
| B. | 碱金属元素是指ⅠA族的所有元素 | |
| C. | 除第1周期外,其他周期均有18种元素 | |
| D. | 7个横行代表7个周期,18个纵行代表18个族 |
2. 分别与CH3CH2OH反应,生成的酯的相对分子质量大小关系( )
分别与CH3CH2OH反应,生成的酯的相对分子质量大小关系( )
 分别与CH3CH2OH反应,生成的酯的相对分子质量大小关系( )
分别与CH3CH2OH反应,生成的酯的相对分子质量大小关系( )| A. | 前者大于后者 | B. | 前者小于后者 | C. | 前者等于后者 | D. | 无法确定 |
 ;
;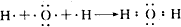 ;
; 和
和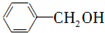 两种物质的试剂是a.
两种物质的试剂是a.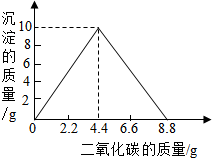 某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:
某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题: