题目内容
20.下列说法正确的是( )| A. | 常温下,pH=11的NaOH和pH=11的KCN溶液中,水的电离程度相等 | |
| B. | 常温下,往Fe(OH)3悬浊液中分别加入少量NaClO、NH4Cl溶液,的溶解度都增大 | |
| C. | NH4Fe(SO4)2溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | |
| D. | 10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合后:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
分析 A.酸碱抑制水的电离,易水解的盐促进水的电离;
B.在一定温度下,某固态物质在100g溶剂中达达到饱和状态所溶解的质量,叫做这种物质在这种溶剂中的溶解度;
C.根据电荷守恒分析;
D.10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合,反应生成醋酸和氯化钠,还有剩余的醋酸钠,溶液显酸性.
解答 解:A.酸碱抑制水的电离,易水解的盐促进水的电离,所以pH=11的NaOH溶液中水的电离被抑制,pH=11的KCN溶液中水的电离被促进,所以两种溶液中水的电离程度不同,故A错误;
B.在一定温度下,某固态物质在100g溶剂中达达到饱和状态所溶解的质量,叫做这种物质在这种溶剂中的溶解度,同一中物质,温度一定时溶解度不变,所以Fe(OH)3的溶解度不变,故B错误;
C.NH4Fe(SO4)2溶液存在电荷守恒,即溶液中正电荷的总浓度等于负电荷的总浓度,所以溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+),故C正确;
D.10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合,反应生成醋酸和氯化钠,还有剩余的醋酸钠,溶液显酸性,则离子浓度关系:c(Cl-)>c(Na+)>c(H+)>c(OH-),故D错误.
故选C.
点评 本题考查了影响水的电离的因素、溶解度的概念、盐的水解和弱电解质的电离,题目涉及的知识点较多,侧重于考查学生对基本原理的应用能力,注意把握溶液中守恒关系的应用,题目难度中等.

练习册系列答案
相关题目
10.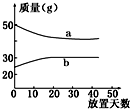 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )
 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如右图所示,分析a、b曲线变化的原因是( )| A. | a升华、b冷凝 | B. | a蒸发、b吸水 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
11.下列关于化学反应与能量的说法中不正确的是( )
| A. | 反应Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3•H2O+8H2O过程中的能量变化情况符合如图 | |
| B. | 氢氧燃料电池的总反应为:2H2+O2=2H2O | |
| C. | 化学平衡状态指的是反应物和生成物浓度不再改变时的状态 | |
| D. | 催化剂既能加快化学反应速率,又能提高原料利用率或转化率 |
8.分子中碳与氢两元素的质量比为24:5的烃的一氯代物共有( )
| A. | 4种 | B. | 3种 | C. | 6种 | D. | 5种 |
15.下列实验中,所选装置不合理的是( )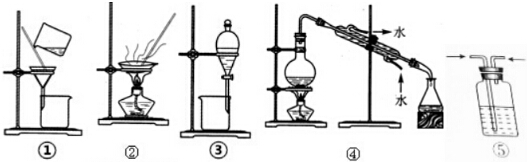

| A. | 装置①和②可进行粗盐提纯实验 | |
| B. | 装置③可进行分离Na2CO3溶液和CH3COOC2H5的实验 | |
| C. | 装置④可进行利用自来水制取少量蒸馏水的实验 | |
| D. | 装置⑤可进行用浓硫酸干燥氯气的实验 |
5.对分子量为104的烃的下列说法,正确的组合是( )
①可能是芳香烃 ②可能发生加聚反应 ③分子中不可能都是单键 ④分子中可能都是单键.
①可能是芳香烃 ②可能发生加聚反应 ③分子中不可能都是单键 ④分子中可能都是单键.
| A. | 只有①② | B. | 只有①③ | C. | 只有①②③ |
16.在同温同压下,相同体积的氢气和氦气具有相同的( )
| A. | 原子数 | B. | 质量 | C. | 中子数 | D. | 质子数 |
17.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度为( )mol•L-1.
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
 .
.