题目内容
6. 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )| A. | 电子由X极通过外电路移向Y极 | |
| B. | 电池工作时,Li+通过离子导体移向b区 | |
| C. | 负极发生的反应为:2H++2e-═H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
分析 加入稀盐酸,在X极上生成氢气,发生还原反应,电极方程式为2H++2e-═H2↑,为正极反应,Y极生成Cl2,为负极反应,发生Cl--2e-=Cl2↑,以此解答该题.
解答 解:A.生成氯气的Y极发生氧化反应,为负极,电子由Y极通过外电路移向X极,故A错误;
B.电池工作时,Li+向正极移动,故B错误;
C.在X极上生成氢气,发生还原反应,电极方程式为2H++2e-═H2↑,故C错误;
D.Y极每生成1 mol Cl2,则转移2mol电子,有2molLi+向正极移动,则a区得到2 mol LiCl,故D正确.
故选D.
点评 本题考查原电池的工作原理,注意根据总反应式结合物质所含元素化合价的变化判断原电池的正负极,把握电极方程式的书写方法,易错点为C,注意浓差电池与一般原电池的区别,题目难度中等.

练习册系列答案
相关题目
16.在同温同压下,相同体积的氢气和氦气具有相同的( )
| A. | 原子数 | B. | 质量 | C. | 中子数 | D. | 质子数 |
17.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度为( )mol•L-1.
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
14.某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验.将合金3.0克投入到足量的100mL 1.5mol•L-1的烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0mol•L-1的盐酸,加入盐酸的体积与得到沉淀的数据如表:
(1)开始沉淀时加入的盐酸体积必须大于70 mL;若得到沉淀的量最大时,加入的盐酸体积为150mL.
(2)合金中铝的质量分数为72%.
| 实验次数 | 加入盐酸的体积 | 沉淀质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 180mL | 5.46g |
(2)合金中铝的质量分数为72%.
1.向平衡CH3COOH+HOCH2CH3$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$CH3COOCH2CH3+H2O中加入CH3CH218OH,则平衡时,含有18O的物质的种类是( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
18.实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表.
试剂:①镁条、②铝条、③氯水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液.
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | 溶液由无色变为黄色(或橙黄) |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
15.下列有机化学方程式书写正确的是( )
| A. | CH4+Cl$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3COOCH2CH3$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH |
16.下列叙述正确的是( )
| A. | CH4和CH3CH2CH2CH3分子组成相差2个-CH2-,因此二者是同系物 | |
| B. | 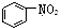 是芳香烃 是芳香烃 | |
| C. | 醇类的官能团是-CHO | |
| D. | 凡是含有碳元素的化合物都属于有机物 |
