题目内容
12.如图是一个电化学过程的示意图,用甲醇燃料电池给充电宝充电,并电解某盐溶液,其中充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4.请回答下列问题: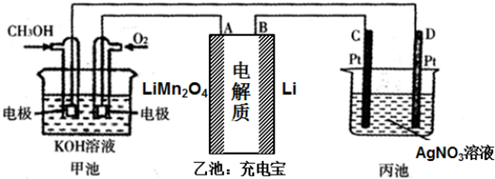
(1)甲池是原电池(填“原电池”或“电解池”),写出通入氧气的电极的电极反应式O2+4e-+2H2O═4OH-
(2)下列关于乙池的说法正确的是abd
a.A极的电极反应式为LiMn2O4-xe-═Li1-xMn2O4+xLi+
b.B极发生还原反应
c.乙池中Li+向A极移动
d.A极是阳极
(3)理论上,当甲池中消耗标准状况下336mL O2 时,丙池中D(C 或D)电极上增重6.48g.
分析 (1)甲装置中能发生自发的氧化还原反应,属于原电池,正极上氧气得电子,负极上燃料失电子;
(2)a.A与正极相连为阳极,阳极上LiMn2O4失电子;
b.B与负极相连为阴极;
c.电解时,阳离子向阴极移动;
d.A与正极相连为阳极;
(3)D与负极相连为阴极,阴极上银离子得电子生成Ag,根据电子守恒计算.
解答 解:(1)甲装置中能发生自发的氧化还原反应,属于原电池,碱性条件下,负极上甲醇失电子生成碳酸根离子和水,正极上氧气得电子生成氢氧根离子,则正极的电极方程式为:O2+4e-+2H2O═4OH-;
故答案为:原电池;O2+4e-+2H2O═4OH-;
(2)a.A与正极相连为阳极,阳极上LiMn2O4失电子,则阳极的电极方程式为:LiMn2O4-xe-═Li1-xMn2O4+xLi+,故a正确;
b.B与通入甲醇的一极相连,即与负极相连为阴极,阴极上发生得电子的还原反应,故b正确;
c.A与正极相连为阳极,电解时,阳离子向阴极移动,即乙池中Li+向B极移动,故c错误;
d.A与通入氧气的一极相连,即A正极相连为阳极,故d正确;
故答案为:abd;
(3)当甲池中消耗标准状况下336mL O2 时,即消耗氧气为$\frac{0.336L}{22.4L/mol}$=0.015mol,则转移电子为0.06mol,D与负极相连为阴极,阴极上银离子得电子生成Ag,转移0.06mol电子时生成0.06mol银,则银的质量为0.06mol×108g/mol=6.48g;
故答案为:D;6.48g.
点评 本题考查化学电源新型电池和电解原理的应用,题目难度中等,本题注意根据电池总反应式正确判断电极反应,并能书写电极反应式是解答该题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列实验中,所选装置不合理的是( )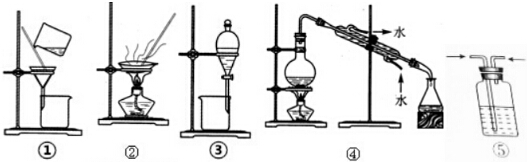

| A. | 装置①和②可进行粗盐提纯实验 | |
| B. | 装置③可进行分离Na2CO3溶液和CH3COOC2H5的实验 | |
| C. | 装置④可进行利用自来水制取少量蒸馏水的实验 | |
| D. | 装置⑤可进行用浓硫酸干燥氯气的实验 |
20.下列有关说法正确的是( )
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
7.下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是:①Na2O2和H2O②Al和NaOH溶液 ③MnO2和浓盐酸共热 ④铜片和浓硫酸共热( )
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有③④ |
17.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度为( )mol•L-1.
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
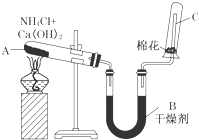 实验室中用如图所示装置制取干燥的氨气.
实验室中用如图所示装置制取干燥的氨气. ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.