题目内容
8.向含有1mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,此时生成的Al(OH)3的物质的量是( )| A. | 1mol | B. | 1.33mol | C. | 0.667mol | D. | 0mol |
分析 SO42-+Ba2+=BaSO4↓,所以向含有1mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,则加入的氢氧化钡为2mol,所以Al3+与OH-物质的量分别为1mol、4mol,恰好反应Al3++4OH-=A1O2-+2H2O,没有沉淀生成.
解答 解:溶液含有1mol KAl(SO4)2,所以含有SO42-2mol.加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,
由反应SO42-+Ba2+=BaSO4↓可知,加入的氢氧化钡含有2molBa2+,即需加入2molBa(OH)2.
由于溶液含有1mol KAl(SO4)2,则含有1molAl3+,加入2molBa(OH)2,提供4molOH-,恰好反应Al3++4OH-=A1O2-+2H2O,没有沉淀生成.
故选:D.
点评 本题考查离子方程式的有关计算,难度中等,关键清楚发生反应的本质,根据SO42-恰好转化为沉淀判断加入Ba(OH)2的物质的量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列关于化学反应与能量的说法中不正确的是( )
| A. | 反应Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3•H2O+8H2O过程中的能量变化情况符合如图 | |
| B. | 氢氧燃料电池的总反应为:2H2+O2=2H2O | |
| C. | 化学平衡状态指的是反应物和生成物浓度不再改变时的状态 | |
| D. | 催化剂既能加快化学反应速率,又能提高原料利用率或转化率 |
16.在同温同压下,相同体积的氢气和氦气具有相同的( )
| A. | 原子数 | B. | 质量 | C. | 中子数 | D. | 质子数 |
13.已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )

| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3 mol | |
| C. | 当通入1mol Cl2时,溶液中已发生的反应为2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
20.下列有关说法正确的是( )
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
17.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度为( )mol•L-1.
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
18.实验室通过简单的“试管实验”,即可探索元素的金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表.
试剂:①镁条、②铝条、③氯水、④AlCl3溶液、⑤MgCl2溶液、⑥NaBr溶液、⑦氢硫酸、⑧水、⑨NaOH溶液.
| 实验方案(只要求填写选用试剂) | ① | ② |
| 填试剂序号 | 填试剂序号 | |
| 实验现象 | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失 | 溶液由无色变为黄色(或橙黄) |
| 有关反应的离子方程式 | ①Al3++3OH-═Al(OH)3↓ ②Al(OH)3+OH-═AlO2-+H2O 或③Al3++4OH-═AlO2-+2H2O ④Mg2++2OH-═Mg(OH)2↓ | Cl2+2Br-=2Cl-+Br2 |
| 结论 | 金属性:Mg>Al | 非金属性:Cl>Br |
 .
.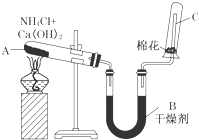 实验室中用如图所示装置制取干燥的氨气.
实验室中用如图所示装置制取干燥的氨气.