题目内容
常温时,下列叙述正确的是( )
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.常温下,pH=9的NH4Cl与NH3?H2O混合溶液c(OH-)>c(H+),再结合电荷守恒得;
B.c(H+)=10-pH;
C.氯离子抑制氯化银的溶解,氯离子浓度越大,其抑制程度越大;
D.温度不变,水的离子积常数不变.
B.c(H+)=10-pH;
C.氯离子抑制氯化银的溶解,氯离子浓度越大,其抑制程度越大;
D.温度不变,水的离子积常数不变.
解答:
解:A.常温下,pH=9的NH4Cl与NH3?H2O混合溶液c(OH-)>c(H+),再结合电荷守恒判断c(Cl-)<c(NH4+),故A错误;
B.c(H+)=10-pH,pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍,故B正确;
C.氯离子抑制氯化银的溶解,氯离子浓度越大,其抑制程度越大,0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中c(Cl-)CaCl2>0.1mol/L NaCl,所以AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度前者小于后者,故C错误;
D.温度不变,水的离子积常数不变,所以1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,Kw不变,故D错误;
故选B.
B.c(H+)=10-pH,pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍,故B正确;
C.氯离子抑制氯化银的溶解,氯离子浓度越大,其抑制程度越大,0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中c(Cl-)CaCl2>0.1mol/L NaCl,所以AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度前者小于后者,故C错误;
D.温度不变,水的离子积常数不变,所以1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,Kw不变,故D错误;
故选B.
点评:本题考查了弱电解质的电离、难溶物的溶解平衡、盐类水解等知识点,明确弱电解质及盐类水解特点是解本题关键,再结合难溶物溶解的影响因素来分析解答,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
 英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
下列说法正确的( )
| A、“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
| D、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
 将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )
将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )| A、在进行到3分钟时,CO2和H2所表达的反应速率值相等,均为0.5mol?L-1?min-1 | ||
| B、此反应的热化学方程式为:CO2(g)+3H2(g)?CH4O(g)+H2O(g)△H=-49.0KJ/mol | ||
C、此条件下反应的平衡常数为
| ||
| D、降低温度,此反应的平衡常数可能为0.8 |
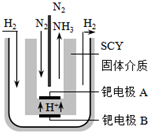 随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )| A、电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B、钯电极B连接的是电源的负极 |
| C、钯电极A的电极反应式为:N2+6e-+6H+═2NH3 |
| D、当有0.3mol电子转移时,有2.688L NH3生成 |
下列说法正确的是( )
| A、甲苯是饱和烃,氯乙烯是不饱和烃 |
| B、石油的裂化产品能使溴水褪色 |
| C、蛋白质在CuSO4溶液中发生盐析 |
| D、油脂在NaOH溶液中水解生成高级脂肪酸和甘油 |
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能形成化合物BA3 |
| B、C的原子半径、离子半径均分别小于D的原子半径、离子半径 |
| C、A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离 |
| D、A、D均能与C形成原子个数比为1:1、2:1的化合物,且A2C2与D2C2的化学键类型相同 |
下列各组离子在指定环境中一定能大量共存的是( )
| A、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、c(OH-)=10-13mol?L-1的溶液中:SO32-、CO32-、Na+、K+ |
| C、在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- |
| D、加入Mg能放出H2的溶液中:K+、NH4+、Cl-、SO42- |
人体血液中存在平衡:CO2+H2O?H2CO3
HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随c(HCO3-):c(H2CO3)变化关系如下表所示,则下列说法中不正确的是( )
| OH- |
| H- |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) |
| B、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 |
| C、常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变 |
| D、c(HCO3-):c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度 |