题目内容
人体血液中存在平衡:CO2+H2O?H2CO3
HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随c(HCO3-):c(H2CO3)变化关系如下表所示,则下列说法中不正确的是( )
| OH- |
| H- |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) |
| B、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 |
| C、常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变 |
| D、c(HCO3-):c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度 |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.根据图中数据判断,pH=7的血液中,c(HCO3-)>c(H2CO3);
B.人体发生酸中毒时,可静脉滴注一定浓度的碱性NaHCO3溶液解毒;
C.温度不变,水的离子积常数不变;
D.碳酸的电离程度远远大于碳酸氢根离子电离程度.
B.人体发生酸中毒时,可静脉滴注一定浓度的碱性NaHCO3溶液解毒;
C.温度不变,水的离子积常数不变;
D.碳酸的电离程度远远大于碳酸氢根离子电离程度.
解答:
解:A.根据图中数据判断,当pH=6.10时,c(HCO3-)=c(H2CO3),当pH>6.10时,c(HCO3-)>c(H2CO3),所以pH=7的血液中,c(HCO3-)>c(H2CO3),故A正确;
B.人体发生酸中毒时,可静脉滴注弱碱性物质解毒,碳酸氢钠溶液呈弱碱性,所以人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒,故B正确;
C.温度不变,水的离子积常数不变,所以常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变,故C正确;
D.由表中数据可知,c(HCO3-):c(H2CO3)=1时,溶液呈酸性,说明碳酸的电离程度大于碳酸氢根离子电离程度,故D错误;
故选D.
B.人体发生酸中毒时,可静脉滴注弱碱性物质解毒,碳酸氢钠溶液呈弱碱性,所以人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒,故B正确;
C.温度不变,水的离子积常数不变,所以常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变,故C正确;
D.由表中数据可知,c(HCO3-):c(H2CO3)=1时,溶液呈酸性,说明碳酸的电离程度大于碳酸氢根离子电离程度,故D错误;
故选D.
点评:本题考查了盐类水解,正确理解表中数据之间的关系是解本题关键,再结合弱电解质的电离、盐类水解特点来分析解答,题目难度不大.

练习册系列答案
相关题目
常温时,下列叙述正确的是( )
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
| B、在0.1mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | ||
| C、在0.1mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
D、在
|
下列有关有机物的说法正确的是( )
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
下列有关实验的叙述正确的是( )
| A、用浓硝酸做试剂比较铁和铜的金属活动性 |
| B、用干燥洁净的玻璃棒蘸取氯水滴在干燥PH试纸上,测定氯水的PH |
| C、向两只分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高 |
| D、欲检验Br-的存在,可在溶液中先加入氯水,再加入CCl4,振荡、静置,观察下层溶液是否出现橙红色 |
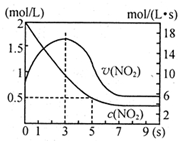 某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )| A、5s时NO2的转化率为75% |
| B、0-3s时v(NO2)增大是由于体系温度升高 |
| C、3s时化学反应处于平衡状态 |
| D、9s时再充入N2O4,平衡后K较第一次平衡时大 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温下,9g H2O中含NA个O-H键 |
| B、1mol Fe2+与足量稀硝酸反应,转移3NA个电子 |
| C、常温常压下,22.4L SO2和O2的混合气体中含2NA个氧原子 |
| D、0.1mol?L-1 KAl(SO4)2溶液中含0.2NA个SO42- |