题目内容
 将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )
将CO2在一定条件下与H2反应转化为甲醇(CH4O)是变废为宝的好方法,一定条件下,每转化1kg CO2放出的热量为1113.64KJ,CO2转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是( )| A、在进行到3分钟时,CO2和H2所表达的反应速率值相等,均为0.5mol?L-1?min-1 | ||
| B、此反应的热化学方程式为:CO2(g)+3H2(g)?CH4O(g)+H2O(g)△H=-49.0KJ/mol | ||
C、此条件下反应的平衡常数为
| ||
| D、降低温度,此反应的平衡常数可能为0.8 |
考点:化学平衡建立的过程,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、依据反应速率概念分析计算,V=
计算分析;
B、每转化1kg CO2放出的热量为1113.64KJ,反应44g二氧化碳放热=
×1113.6KJ=49KJ,依据热化学方程式书写方法书写分析判断;
C、依据图象计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、反应是放热反应,降温平衡正向进行,平衡常数增大.
| △c |
| △t |
B、每转化1kg CO2放出的热量为1113.64KJ,反应44g二氧化碳放热=
| 44g |
| 1000g |
C、依据图象计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、反应是放热反应,降温平衡正向进行,平衡常数增大.
解答:
解:A、是CO2和H2在3分钟时浓度相等,则速率分别为
=
=0.25/mol?min与
=
=0.75mol/L?min,速率不同,故A错误;
B、首先从图象可看出,反应物为H2.CO2(浓度降低),生成物为CH4O;再从浓度的变化量的最简单整数比可确定它们的系数为3.1.1,结合质量守恒原理,可知生成物中还有1molH2O;再根据反应热求出△H=-1113.64KJ÷
=-49.0KJ/mol,热化学方程式为:CO2(g)+3H2(g)?CH4O(g)+H2O(g)△H=-49.0KJ/mol,故B正确;
C、平衡常数K=
=1.07,故C错误;
D、降温平衡向正反应方向移动,平衡常数增大(>1.07),不可能为0.8,故D错误.
故选B.
| 2.00mol/L-1.25mol/L |
| 3min |
| 0.75mol/L |
| 3min |
| 3.00mol/L-0.75mol/L |
| 3min |
| 2.25mol/L |
| 3min |
B、首先从图象可看出,反应物为H2.CO2(浓度降低),生成物为CH4O;再从浓度的变化量的最简单整数比可确定它们的系数为3.1.1,结合质量守恒原理,可知生成物中还有1molH2O;再根据反应热求出△H=-1113.64KJ÷
| 1000g |
| 44g/mol |
C、平衡常数K=
| 0.75×0.75 |
| 0.753×1.25 |
D、降温平衡向正反应方向移动,平衡常数增大(>1.07),不可能为0.8,故D错误.
故选B.
点评:本题考查了化学反应速率、平衡常数概念计算应用,图象分析计算平衡浓度,平衡常数影响因素分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关物质性质的应用正确的是( )
| A、常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 |
| B、铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| C、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
| D、次氯酸钠具有强氧化性,可用于配制消毒液 |
现有X、Y、Z三种常见短周期元素,Y、Z为同周期金属元素,且X和Y的某种化合物为淡黄色固体M,Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水.下列说法不正确的是( )
| A、固体M能与水反应生成X单质和一种强碱 |
| B、Z单质的薄片在酒精灯上加热能熔化,但不滴落 |
| C、Y的最高价氧化物对应的水化物和盐N均能抑制水的电离 |
| D、M和N中均含有离子键和共价键 |
几种短周期元素的原子半径及主要化合价如下表:下列说法正确的是( )
| 元素代号 | X | Y | Z | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、Y2+的半径比T2-的半径大 |
| C、Z2R3不能在水溶液中存在 |
| D、元素X和T形成的化合物中不可能含有共价键 |
有机化合物A转化为B的反应如下,下列说法正确的是( )


| A、B的分子式为C16H14O2 |
| B、上述转化属于还原反应 |
| C、二者均为芳香烃 |
| D、二者均能发生加成、酯化反应 |
常温时,下列叙述正确的是( )
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |
下列有关有机物的说法正确的是( )
| A、甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
| B、米酒变酸的过程涉及了氧化反应 |
| C、乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 |
| D、淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应 |
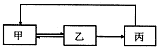 下表中各组物质之间不能通过一步反应实现如图转化的是( )
下表中各组物质之间不能通过一步反应实现如图转化的是( )