题目内容
 英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃料电池新技术.用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:尿素燃料电池中尿素在负极上失去电子生成氮气、二氧化碳,为氧化反应,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+,正极通入氧气,电极方程式为O2+4H++4e-═2H2O,结合电极方程式解答该题.
解答:
解;A.原电池中阳离子向正极移动,则电池工作时H+移向正极,故A错误,故A错误;
B.该装置为原电池,原电池是把化学能转化为电能的装置,故B错误;
C.电池的总反应式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,消耗67.2L O2,如果是标准状况,则消耗的氧气的物质的量为3mol,则可以净化2mol CO(NH2)2,由于没说明是标准状况,所以氧气的物质的量不能求算,故C错误;
D.负极上是CO(NH2)2失电子生成二氧化碳和氮气,则负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+,故D正确.
故选D.
B.该装置为原电池,原电池是把化学能转化为电能的装置,故B错误;
C.电池的总反应式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,消耗67.2L O2,如果是标准状况,则消耗的氧气的物质的量为3mol,则可以净化2mol CO(NH2)2,由于没说明是标准状况,所以氧气的物质的量不能求算,故C错误;
D.负极上是CO(NH2)2失电子生成二氧化碳和氮气,则负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+,故D正确.
故选D.
点评:本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为C,注意气体存在的外界条件,题目难度中等.

练习册系列答案
相关题目
已知β一紫罗兰酮的结构简式是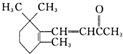 ,关于该有机物的说法正确的是( )
,关于该有机物的说法正确的是( )
 ,关于该有机物的说法正确的是( )
,关于该有机物的说法正确的是( )| A、其分子式为C13H18O |
| B、能使溴的四氯化碳溶液、酸性高锰酸钾溶液退色 |
| C、属于芳香族化合物 |
| D、能发生加成反应、取代反应、水解反应 |
下列说法不正确的是( )
| A、汽车尾气中有NOx,主要是汽油不充分燃烧引起的 |
| B、日用铝制品表面覆盖着氧化膜,对金属起保护作用 |
| C、实验室常用粗锌和稀硫酸反应制取H2 |
| D、从海水中提取溴的过程涉及氧化还原反应 |
下列有关物质性质的应用正确的是( )
| A、常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 |
| B、铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀 |
| C、二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 |
| D、次氯酸钠具有强氧化性,可用于配制消毒液 |
分类是化学研究的重要方法之一,下列有关说法中,正确的是( )
| A、SO2、NO2和CO2都属于酸性氧化物 |
| B、甲烷和和一氯甲烷都属于烷烃 |
| C、HC1O是弱电解质,NaClO却属于强电解质 |
| D、在水溶液中能电离出H+的化合物都属于酸 |
以下性质的比较可能错误的是( )
| A、离子半径 H->Li+ |
| B、熔点 Al2O3>MgO |
| C、结合质子(H+)的能力 CO32->ClO- |
| D、密度 1-氯戊烷>1-氯己烷 |
常温时,下列叙述正确的是( )
| A、pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B、pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的10倍 |
| C、AgCl在0.1mol/L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D、1mL 1mol?L-1 Na2CO3溶液加水稀释至100mL,pH和Kw均减小 |