题目内容
工业生产纯碱的工艺流程如图所示:

请回答下列问题:
(1)工艺流程中多次用到“过滤”操作,过滤操作中用到的玻璃仪器有 .
(2)实验过程中先“氨化”,后“碳酸化”,理由是 .
(3)工业纯碱含有少量碳酸氢钠,某兴趣小组为测定某工业纯碱中碳酸钠的质量分数,设计了下列实验方案:
方案一:分别称量干燥坩埚(m1 g)和纯碱样品的质量(m2 g),将纯碱样品放人坩埚中充分加热.将坩埚置于干燥器中冷却后称量,重复“加热、冷却、称量”操作多次后,最终称量坩埚和剩余样品的总质量为m3 g,则样品中纯碱的质量分数为 (用含m1、m2、m3的代数式表示).
方案二:正确称取样品w g,用如图装置进行实验.
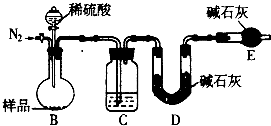
①装置C中试剂是 .
②E装置的作用是 ,若不连接E装置所测Na2CO3的质量分数 (填“偏大”、“偏小”或“无影响”).
③反应前通入N2,反应后继续通人N2的目的是 .
(4)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述) .
②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 .(已知:酸性H2CO3>HClO>HCO3-).

请回答下列问题:
(1)工艺流程中多次用到“过滤”操作,过滤操作中用到的玻璃仪器有
(2)实验过程中先“氨化”,后“碳酸化”,理由是
(3)工业纯碱含有少量碳酸氢钠,某兴趣小组为测定某工业纯碱中碳酸钠的质量分数,设计了下列实验方案:
方案一:分别称量干燥坩埚(m1 g)和纯碱样品的质量(m2 g),将纯碱样品放人坩埚中充分加热.将坩埚置于干燥器中冷却后称量,重复“加热、冷却、称量”操作多次后,最终称量坩埚和剩余样品的总质量为m3 g,则样品中纯碱的质量分数为
方案二:正确称取样品w g,用如图装置进行实验.

①装置C中试剂是
②E装置的作用是
③反应前通入N2,反应后继续通人N2的目的是
(4)纯碱在生产生活中有广泛的应用.
①纯碱可用于除灶台油污.其原因是(结合离子方程式表述)
②工业上,可以用纯碱代替烧碱生产某些化工产品.如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)过滤用到的玻璃仪器有烧杯、漏斗和玻璃棒;
(2)根据氨气和二氧化碳的溶解性判断;
(3)方案一:碳酸氢钠不稳定,加热易分解,根据质量变化可计算碳酸氢钠的质量,进而计算纯碱的质量分数;
方案二:原理是利用硫酸和样品反应生成二氧化碳,用浓硫酸除去二氧化碳中的水,用碱石灰吸收二氧化碳,根据二氧化碳的质量列方程组可计算质量分数,为减小实验误差,应通入氮气将装置内的二氧化碳全部排出,保证被完全吸收;
(4)纯碱为强碱弱酸盐,水解呈碱性,油污可在碱性条件下水解;氯气在碱性条件下反应可生成次氯酸盐.
(2)根据氨气和二氧化碳的溶解性判断;
(3)方案一:碳酸氢钠不稳定,加热易分解,根据质量变化可计算碳酸氢钠的质量,进而计算纯碱的质量分数;
方案二:原理是利用硫酸和样品反应生成二氧化碳,用浓硫酸除去二氧化碳中的水,用碱石灰吸收二氧化碳,根据二氧化碳的质量列方程组可计算质量分数,为减小实验误差,应通入氮气将装置内的二氧化碳全部排出,保证被完全吸收;
(4)纯碱为强碱弱酸盐,水解呈碱性,油污可在碱性条件下水解;氯气在碱性条件下反应可生成次氯酸盐.
解答:
解:(1)过滤用到的玻璃仪器有烧杯、漏斗和玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(2)氨气易溶于水,且溶液呈碱性,有利于二氧化碳的吸收,故答案为:氨化后溶液呈碱性,有利于吸收二氧化碳;
(3)方案一:碳酸氢钠不稳定,加热易分解,发生:2NaHCO3
Na2CO3+CO2↑+H2O,加热前坩埚和样品的质量为(m1+m2)g,加热后坩埚和剩余样品的总质量为m3 g,
则2NaHCO3
Na2CO3+CO2↑+H2O△m
168g 106g 62g
x (m1+m2-m3)g
x=
g,
所以m(Na2CO3)=m2 g-
g,
所以样品中纯碱的质量分数为[1-
]×100%,
故答案为:[1-
]×100%;
方案二:原理是利用硫酸和样品反应生成二氧化碳,用浓硫酸除去二氧化碳中的水,用碱石灰吸收二氧化碳,根据二氧化碳的质量列方程组可计算质量分数,为减小实验误差,应通入氮气将装置内的二氧化碳全部排出,保证被完全吸收,则
①C中盛有浓硫酸,用于除去二氧化碳气体中的水,故答案为:浓硫酸;
②E可防止空气中的水蒸气、二氧化碳进入D装置,以免造成实验误差,导致误差偏小,故答案为:防止空气中的水蒸气、二氧化碳进入D装置;偏小;
③反应前通入氮气,可将装置内的空气排出,反应后继续通入氮气,可将装置内的二氧化碳全部排出,保证被完全吸收,
故答案为:排进装置内的空气;将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收;
(4)①纯碱为强碱弱酸盐,水解呈碱性,油污可在碱性条件下水解,反应的离子方程式为CO32-+H2O?HCO3-+OH-,
故答案为:CO32-水解呈碱性CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解,达到去污目的;
②纯碱为强碱弱酸盐,水解呈碱性,氯气在碱性条件下反应可生成次氯酸盐,反应的离子方程式为2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-,
故答案为:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-.
(2)氨气易溶于水,且溶液呈碱性,有利于二氧化碳的吸收,故答案为:氨化后溶液呈碱性,有利于吸收二氧化碳;
(3)方案一:碳酸氢钠不稳定,加热易分解,发生:2NaHCO3
| ||
则2NaHCO3
| ||
168g 106g 62g
x (m1+m2-m3)g
x=
| 84(m1+m2-m3) |
| 31 |
所以m(Na2CO3)=m2 g-
| 84(m1+m2-m3) |
| 31 |
所以样品中纯碱的质量分数为[1-
| 84(m1+m2-m3) |
| 31m2 |
故答案为:[1-
| 84(m1+m2-m3) |
| 31m2 |
方案二:原理是利用硫酸和样品反应生成二氧化碳,用浓硫酸除去二氧化碳中的水,用碱石灰吸收二氧化碳,根据二氧化碳的质量列方程组可计算质量分数,为减小实验误差,应通入氮气将装置内的二氧化碳全部排出,保证被完全吸收,则
①C中盛有浓硫酸,用于除去二氧化碳气体中的水,故答案为:浓硫酸;
②E可防止空气中的水蒸气、二氧化碳进入D装置,以免造成实验误差,导致误差偏小,故答案为:防止空气中的水蒸气、二氧化碳进入D装置;偏小;
③反应前通入氮气,可将装置内的空气排出,反应后继续通入氮气,可将装置内的二氧化碳全部排出,保证被完全吸收,
故答案为:排进装置内的空气;将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收;
(4)①纯碱为强碱弱酸盐,水解呈碱性,油污可在碱性条件下水解,反应的离子方程式为CO32-+H2O?HCO3-+OH-,
故答案为:CO32-水解呈碱性CO32-+H2O?HCO3-+OH-,油污在碱性条件下水解,达到去污目的;
②纯碱为强碱弱酸盐,水解呈碱性,氯气在碱性条件下反应可生成次氯酸盐,反应的离子方程式为2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-,
故答案为:2CO32-+Cl2+H2O=Cl-+ClO-+2HCO3-.
点评:本题考查较为综合,为高考常见题型,侧重于学生的分析能力、计算能力和实验能力的考查,注意把握物质的性质以及反应的实验原理,难度中等.

练习册系列答案
相关题目
下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )

| A、甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
| B、乙是等PH值的MCl2和NCl2溶液稀释时PH值变化图,由此可推测M的金属性较强 |
| C、由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)=2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ?mol-1 |
| D、丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |
标准状况下,将a L SO2和Cl2组成的混合气体通入100mL 0.2mol?L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅.向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g.则下列关于该过程的推断不正确的是( )
| A、混合气体中氯气物质的量为0.04mol |
| B、混合气体中SO2物质的量为0.04mol |
| C、所得的沉淀为0.1mol BaSO4 |
| D、a的取值范围为0.896<a<1.792 |

 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.