题目内容
8.化学反应原理在科研和工农业生产中有广泛应用.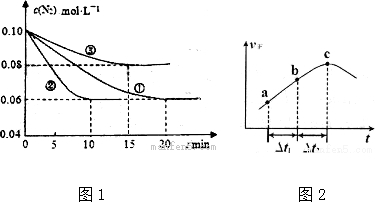
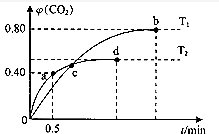
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)?2NH3(g)△H<0.在l L密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如图1所示:实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=0.008mol•L-1•min-1;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的E、C(填字母编号).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)?N2O4(g).
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=5L•mol-1;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将减小(填“增大”、“减小”或“不变”).
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图2所示.下列说法正确的是C(填字母编号)
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.△t1=△t2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将a mol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$mol/L.
分析 (1)根据v=$\frac{△c}{△t}$计算反应速率,根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,①和③比较可知,③的速率比①大,平衡时氮气的浓度高,即平衡逆向移动,故③应为升高温度;
(2)①根据反应方程式,利用平衡常数的定义计算;
②根据温度对平衡常数的影响判断;
③向绝热密闭容器中通入一定量的NO2,根据图象可知,反应开始反应物浓度最大,但反应速率逐渐增大,据此判断;
(3)当a=b时,amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液呈酸性,若溶液显中性,则酸的量要减少,故a>b,根据氨水的电离平衡常数的定义可计算电离平衡常数.
解答 解:(1)根据像可知,②在10min时达到平衡,此时氮气的浓度变化为0.04mol/L,根据方程式或知,氨气的浓度变化了0.08mol/L,
则:v(NH3)=$\frac{0.08mol/L}{10min}$=0.008mol•L-1•min-1;
根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,故E正确;①和③比较可知,③的速率比①大,平衡时氮气的浓度高,即平衡逆向移动,故③升高温度,故C正确,
故答案为:0.008 mol•L-1•min-1;E; C;
(2)①2NO2(g) N2O4(g)
N2O4(g)
起始时 0.2mol•L-1 0
转化 0.1mol•L-1 0.05mol•L-1
平衡时 0.1mol•L-1 0.05mol•L-1
故平衡常数K=$\frac{c(N{{\;}_{2}O}_{4})}{c(N{O}_{2})^{2}}$=$\frac{0.05}{0.{1}^{2}}$L•mol-1=5L•mol-1,
故答案为:5 L•mol-1;
②温度升高,此平衡向逆反应方向移动,K值减小,
故答案为:减小;
③反应开始反应物浓度最大,但反应速率逐渐增大,说明反应为放热反应,
A.c点反应速率最大,但没有达到平衡状态,反应继续向正反应方向进行,c点时转化率不是最大,错误;
B.反应向正反应进行,随着反应的进行,反应物浓度逐渐降低,故B错误;
C、随反应的进行,体系是的温度越来越高,反应速率逐渐增大,当时间相同时,转化率逐渐增大,正确,
故答案为:C;
(3)当a=b时,amol•L-1的氨水与b mol•L一1盐酸等体积混合,反应后溶液呈酸性,若溶液显中性,则酸的量要减少,故a>b.
反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据电荷守恒溶液中c(NH4+)=c(Cl-)=b/2mol/L,反应前c(NH3•H2O)=a/2mol/L,
则反应后一水合氨的浓度为:c(NH3•H2O)=(a/2-b/2)mol/L,所以氨水的电离平衡常数为:K=$\frac{c(N{H}_{4}{\;}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$═$\frac{b×1{0}^{-7}}{a-b}$mol/L,
故答案为:>;$\frac{b×1{0}^{-7}}{a-b}$mol/L.
点评 本题考查化学平衡的计算,为高考常见题型,侧重考查学生的分析能力和计算能力,题目涉及物质的量或浓度随时间的变化曲线、化学平衡常数的含义、化学平衡的影响因素、化学反应速率的影响因素及有关平衡常数的计算,中等难度.

| A. | NH3、NH4+、NH-的电子数相等,化学性质也相同 | |
| B. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| C. | 液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2-) | |
| D. | 加入其他物质,c(NH4+)/c(NH2-)可能不变 |
| A. | 氨水 | B. | 氢氧化钠 | C. | 氢氧化钡 | D. | 氢氧化钙 |
aA (g)+bB (g)?2C(g)
| 起始物质的量(mol) | 3 | 2 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
(2)2s内B的反应速率=0.1mol/(L•s).
| 加入物质 | HCl(aq) | FeCl3 | NaOH | CH3COONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α4>α2 | B. | α4>α2>α5>α3>α1 | C. | α2>α4>α5>α1>α3 | D. | α1>α3>α5>α2>α4 |
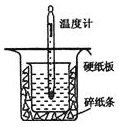 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒_,
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”)
(3)倒入NaOH溶液的正确操作是:C. (从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.