题目内容
20.已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:aA (g)+bB (g)?2C(g)
| 起始物质的量(mol) | 3 | 2 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
(2)2s内B的反应速率=0.1mol/(L•s).
分析 由表格中数据可知,aA (g)+bB (g)?2C(g)
开始 1.5 1 0
转化 0.4
2s 0.9 0.8 0.4
(1)化学计量数之比等于反应速率之比,等于相同时间内浓度变化量之比;
(2)结合v=$\frac{△c}{△t}$计算.
解答 解:(1)化学计量数之比等于反应速率之比,等于相同时间内浓度变化量之比,则a:b:2=(1.5-0.9):(1-0.8):(0.4-0)=3:1:2,则a=3、b=1,
故答案为:3;1;
(2)2s内B的反应速率为$\frac{1mol/L-0.8mol/L}{2s}$=0.1mol/(L•s),
故答案为:0.1mol/(L•s).
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、速率与化学计量数的关系、速率计算为解答的关键,侧重分析与计算能力的考查,注意浓度变化量的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3═H2O+CO2↑ | |
| B. | 氯水与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氯化亚铁溶液中滴加氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
8.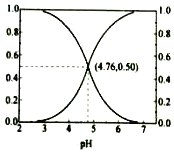 25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )
25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )
 25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )
25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )| A. | 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH) | |
| B. | 在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 | |
| C. | 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) | |
| D. | 在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变 |
15.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).平衡时H2的转化率为50%
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃,当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则v(N2)正>v(N2)逆
(填“<”“>”或“=”)
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L•min).平衡时H2的转化率为50%
(2)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(H2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃,当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则v(N2)正>v(N2)逆
(填“<”“>”或“=”)
5.下列关于卤素的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,能使紫色石蕊试剂先变红后褪色,也可用pH试纸测量其pH值 |
12.化学与生活、生产密切相关.下列有关说法正确的是( )
| A. | 食用醋中含有30%左右的乙酸 | |
| B. | 肥皂在碱性条件下水解可得甘油 | |
| C. | 为增加肥效,将草木灰与铵态氮肥混合施用 | |
| D. | 用pH试纸可检验食盐与假盐(NaNO2) |
10.下列叙述中,正确的是( )
| A. | 同质量的H2和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96 g•mol-1 | |
| C. | 阿伏加德罗常数恰好为6.02×1023mol-1 | |
| D. | 1 mol CO2的质量为44 g/mol |