题目内容
18.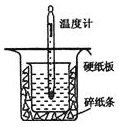 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒_,
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”)
(3)倒入NaOH溶液的正确操作是:C. (从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)为了减少热量散失,使测量结果更加准确,需要迅速将氢氧化钠溶液倒入烧杯中;
(4)①先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;为了保证酸或是碱中的一方完全反应,往往保证一方过量;
③a.实验装置保温、隔热效果必须好;
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱反应放热,导致H2SO4的起始温度偏高;
c.若分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致散失过多的热量
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等;
(3)中和热的测定中,必须尽量减少热量散失,所以倒入氢氧化钠溶液时,必须一次并且迅速倒入烧杯中;
故选:C;
(6))①四次测定温度差分别为:3.4℃,5.1℃,3.3℃,3.5℃,其中第二次的温度差误差较大,应该舍弃,其它三次温度差的平均值为:$\frac{3.4+3.3+3.5}{3}$℃=3.4℃,
故答案为:3.4;
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8 kJ/mol;为了确保硫酸被完全中和,所用NaOH溶液要稍过量;
故答案为:-56.8kJ/mol;确保硫酸被完全中和;
③a.实验装置保温、隔热效果必须好,否则测定结果偏小,故a正确;
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱反应放热,导致H2SO4的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故b正确;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中,则会导致较多热量散失,故c正确;
故答案为:abc.
点评 本题考查中和热的测定,注意理解中和热的概念以及测定反应热的误差等问题,侧重于考查学生的实验能力和计算能力.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案| A. | 溶液中只有离子,没有溶质分子 | |
| B. | 溶液中只有溶质分子,没有离子 | |
| C. | 在弱电解质的电离方程式中,可用“═”表示 | |
| D. | 溶液中分子和离子同时存在 |
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖 |
| A. | 同质量的H2和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96 g•mol-1 | |
| C. | 阿伏加德罗常数恰好为6.02×1023mol-1 | |
| D. | 1 mol CO2的质量为44 g/mol |
 实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题:
实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题: