题目内容
16.某溶液中Cl-、Br-、I-之比为2:3:4,要使溶液中Cl-、Br-、I-之比变为4:3:2,则通入Cl2与原溶液中I-之比为1:4.若溶液中只有Cl-和Br-,而没有I-,则此时Cl-和Br-之比为2≤$\frac{n(C{l}^{-})}{n(B{r}^{-})}$<3.分析 离子的还原性:I->Br->Cl-,由于反应中I-有剩余,则Br-没有被氧化,通入氯气只发生Cl2+2I-=2Cl-+I2,由反应可知,溶液中离子总物质的量不变,故溶液中Br-离子物质的量不变,再利用赋值法,结合离子的物质的量的变化计算;要使溶液中只有Cl-和Br-,而没有I-,可能是碘离子恰好完全反应或者是溴离子部分反应,以此解答该题.
解答 解:离子的还原性:I->Br->Cl-,由于反应中I-有剩余,则Br-没有被氧化,通入氯气只发生Cl2+2I-=2Cl-+I2,设溶液中Cl-、Br-、I-离子的物质的量分别为2xmol、3xmol、4xmol,由反应后离子物质的量关系可知反应离子的物质的量分别为4xmol、3xmol、2xmol,则Cl-的物质的量增加2xmol,I-的物质的量减少2xmol,则通入氯气xmol,则通入Cl2物质的量与原溶液中I-物质的量之比为x:4x=1:4,即为1:4,
要使溶液中只有Cl-和Br-,而没有I-,可能是碘离子恰好完全反应时需氯气的量为:2xmol氯气,生成4xmolCl-,此时溶液中氯离子的物质的量为6xmol;溴离子恰好完全反应需要氯气$\frac{3x}{2}$mol,此时溶液中的氯离子为9xmol;所以则此时Cl-和Br-的物质的量之比为$\frac{6}{3}$=2≤$\frac{n(C{l}^{-})}{n(B{r}^{-})}$<$\frac{9}{3}$=3,
故答案为:1:4;2≤$\frac{n(C{l}^{-})}{n(B{r}^{-})}$<3.
点评 本题考查氧化还原反应的计算,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,本题注意把握离子的还原性强弱,判断发生的反应是关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案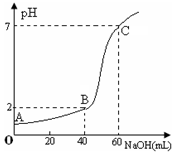 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )| A. | 所用盐酸的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L─1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+) | |
| C. | A、B、C三点水的电离程度大小依次为:C>B>A | |
| D. | 滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低 |
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3═H2O+CO2↑ | |
| B. | 氯水与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氯化亚铁溶液中滴加氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | pH=a 的 CH3COOH 溶液,稀释 10 倍后,其 pH=b,则 a+1<b | |
| B. | pH=5 的 H2CO3 溶液中,c(H+)=c(HCO3-)=1×10-5 mol/L | |
| C. | pH相同的①CH3COONa ②NaHCO3 ③NaCN 三种溶液的 c(Na+):①>②>③ | |
| D. | 等浓度等体积的①CH3COONa 和②NaCN 溶液,溶液中阴离子数目:②>① |
| A. | $\frac{n(m-x)}{m}$ | B. | $\frac{n(m-x+2)}{m}$ | C. | $\frac{m-x+2}{m-x}$ | D. | $\frac{n(m-x-2)}{m}$ |
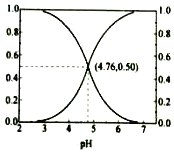 25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )
25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )| A. | 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH) | |
| B. | 在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 | |
| C. | 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) | |
| D. | 在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变 |
 .
.