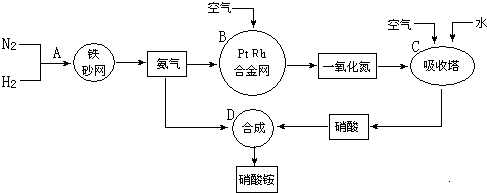
题目内容
13.已知某指定反应物(A)的平衡转化率(α)的数学表达式可用下式表示:α=$\frac{A转化的物质的量}{A的起始物质的量}$×100%下列各项叙述中,表明平衡肯定发生移动的是( )
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
分析 A.对应反应前后气体体积相等的反应,改变压强后平衡不移动;
B.没有气体参与的可逆反应,改变压强后平衡不移动;
C.使用催化剂,可以改变反应速率,但是化学平衡不移动;
D.反应物转化率发生改变,说明化学平衡发生了移动.
解答 解:A.若反应前后气体体积相等,改变压强后浓度会发生变化,但是正逆反应速率仍然相等,则化学平衡不移动,故A错误;
B.对于没有气体参与的反应,改变反应混合物的压强,平衡不发生移动,故B错误;
C.催化剂能够改变反应速率,但不影响平衡,所以平衡后加入催化剂,能够改变反应速率,但是平衡不移动,故C错误;
D.对于可逆反应,若反应物的转化率改变,则化学平衡一定发生了移动,故D正确;
故选D.
点评 本题考查了化学平衡的影响,题目难度不大,明确化学平衡及其影响因素为解答关键,注意浓度、越强、反应速率发生变化,化学平衡不一定移动,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.工业制H2SO4时,对SO2净化和干燥的目的是( )
①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
4.根据实验室测定硫酸铜晶体(CuSO4•5H2O)结晶水含量的实验,填写下列空白.
(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
请写出结晶水x=4.81.本次实验的相对误差=-3.8%.
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
8.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH ③加盐酸 ④加过量Na2CO3 ⑤加过量BaCl2溶液.正确的操作顺序是( )
| A. | ⑤④①③② | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
2.一定条件下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ/mol,在5L密闭容器中进行,10s时,水蒸气的物质的量增加了0.60mol,则下列说法不正确的是( )
| A. | 10s内,NH3的平均反应速率为0.008mol•L-1•s-1 | |
| B. | 该反应达到平衡时6v(O2)正=5v(H2O)逆 | |
| C. | 10s内,反应放出的热量为0.1akJ | |
| D. | 10s时,H2O的反应速率为0.012mol•L-1•s-1 |
3.下列说法正确的是( )
| A. | 在配制一定物质的量浓度溶液的实验中托盘天平,玻璃棒是必需仪器 | |
| B. | 实验室中,盛装NaOH等碱性溶液的试剂瓶用橡皮塞 | |
| C. | 加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
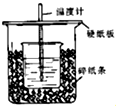 50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50ml0.50mol/L盐酸和50ml0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: