题目内容
3.工业制H2SO4时,对SO2净化和干燥的目的是( )①除尘,避免催化剂中毒;②洗涤,避免催化剂中毒;③干燥,避免催化剂中毒; ④干燥,避免设备腐蚀.
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
分析 工业制备硫酸时,生成的二氧化硫中含有砷、水等杂质,二氧化硫在催化剂条件下发生反应生成三氧化硫,应避免催化剂的中毒,以此解答该题.
解答 解:工业制备硫酸时,生成的二氧化硫中含有砷、水等杂质,二氧化硫在催化剂条件下发生反应生成三氧化硫,可先除尘、洗涤,避免,以避免催化剂的中毒,并且干燥,避免腐蚀设备,
故选B.
点评 本题考查硫酸的工业制备,为高频考点,侧重于化学与生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意把握硫酸的制备原理以及流程,难度不大.

练习册系列答案
相关题目
18.孔雀石的主要成分为Cu2(OH)2CO3还含少量二价铁和三价铁的氧化物及硅的氧化物.如图是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图: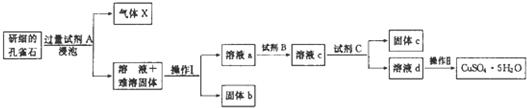
(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离.试剂C宜选用D(填选项序号);
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.

(1)试剂A的化学式是H2SO4;操作I的名称是过滤;
(2)操作Ⅱ的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;用到的仪器有:酒精灯、玻璃棒、蒸发皿、坩埚钳和三角架.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方式:2Fe2++2H++H2O2=2Fe3++2H2O.
(4)已知
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuCO3
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7~4.8.
(5)溶液c中含有的两种金属阳离子,若用色谱分析法检验,固定相是附着在滤纸上的水,滤纸的作用是惰性支持物.在流动相中分配较少的离子是Cu2+、氨熏后的颜色是深蓝色,其氨熏时的离子方程式为Cu2++4NH3•H20═[Cu(NH3)4]2++4H2O.
15.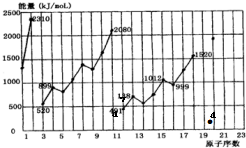 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
(1)硒(Se)的最高价氧化物水化物的化学式为H2SeO4;该族2~5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,请写出1mol硒与H2反应生成气态氢化物的热化学方程式H2(g)+Se(s)═H2Se(g)H=+29.7kJ/mol
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
(2)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是ac(填写编号,多选倒扣)
a、E(砷)>E(硒)
b、E(砷)<E(硒)
c、E(溴)>E(硒)
d、E(溴)<E(硒)
估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围419<E<738.
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
(2)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是ac(填写编号,多选倒扣)
a、E(砷)>E(硒)
b、E(砷)<E(硒)
c、E(溴)>E(硒)
d、E(溴)<E(硒)
估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围419<E<738.
12. (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
试计算该反应的反应热△H=+125kJ/mol.
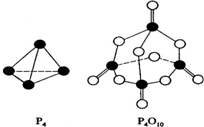
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
根据图示的分子结构和有关数据估算该反应的△H=819kJ•mol-1;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
13.已知某指定反应物(A)的平衡转化率(α)的数学表达式可用下式表示:α=$\frac{A转化的物质的量}{A的起始物质的量}$×100%
下列各项叙述中,表明平衡肯定发生移动的是( )
下列各项叙述中,表明平衡肯定发生移动的是( )
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
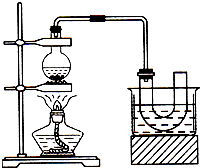 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃): 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答: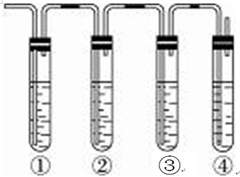 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题: