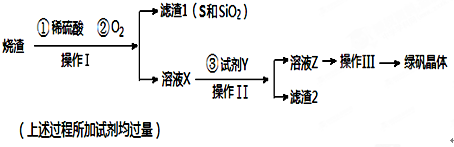
题目内容
4.根据实验室测定硫酸铜晶体(CuSO4•5H2O)结晶水含量的实验,填写下列空白.(1)除需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架等仪器外,从下列仪器中选出所需仪器(用标号字母填写)ABDF.
A.电子天平 B.研钵 C.试管夹 D.坩埚 E.蒸发皿 F.干燥器 G.石棉网
还需要的仪器是泥三角.
(2)某学生实验后得到以下数据:
| 加热前的质量 | 加热后的质量 | ||
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) | |
| 第一次 | 15.688g | 17.668g | 16.962g |
| 第二次 | 15.688g | 17.744g | 17.033g |
(3)该学生测定结果是偏高还是偏低?偏低.从下列选项中选出该学生产生误差的原因可能是(填写字母)BC.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.001g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失.
(4)测定硫酸铜晶体中结晶水的含量,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,判断达到恒重的依据是直到连续两次称量误差不得超过0.001g为止.
分析 (1)实验需要药品的称量以及加热操作,以此判断所用的仪器;
(2)由表中数据可知W3-W1为硫酸铜的质量,W2-W3为结晶水的质量,计算两次的平均值,可计算x并判断误差;
(3)实验结果偏低,在测定中若被测样品中含有加热不挥发的杂质或实验前被测样品已有部分失水,都会造成测量结果偏低;
(4)第三、四次称量为恒重操作,以判断晶体是否完全分解,且取平均值而减小实验误差.
解答 解:(1)实验时应先研磨,需要研钵;然后称量需要电子天平;加热需要酒精灯、玻璃棒、坩埚钳、药匙、三脚架坩埚、泥三角,最后在干燥器中冷却.
故答案为:ABDF;泥三角;
(2)由表中数据可知W3-W1为硫酸铜的质量,为$\frac{(16.962-15.688)+(17.033-15.688)}{2}$=1.3095(g),
W2-W3为结晶水的质量,为$\frac{(17.668-16.962)+(17.744-17.033)}{2}$=0.7085(g),
则x=$\frac{\frac{0.7085g}{18g/mol}}{\frac{1.3095g}{160g/mol}}$=4.81,
相对误差为$\frac{4.81-5}{5}×100%$=-3.8%,
故答案为:4.81;-3.8%;
(3)由(2)计算数值可知实验结果偏低,
A.加热前所用的坩埚未完全干燥.加热后水挥发,导致水的质量测定结果偏大,故A错误;
B.最后两次加热后的质量相差较大(大于0.001g),可能为水没有分解完全,则测定结果偏低,故B正确;
C.加热后容器未放入干燥器中冷却,硫酸铜吸水,导致测定结果偏小,故C正确;
D.加热过程中晶体有少量溅失,导致质量差值偏大,测定结果偏大,故D错误.
故答案为:偏低;BC;
(4)在硫酸铜结晶水含量的测定实验中,实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.001gg为止,一般情况下,至少在天平上进行四次称量,第三、四次称量的目的是进行恒重操作,
故答案为:恒重;直到连续两次称量误差不得超过0.001g为止.
点评 本题考查了硫酸铜晶体中结晶水的测定,为高频考点,侧重于学生的分析能力和实验能力的考查,把握实验操作原理及实验注意事项是解题的关键,此题实际上就来源于课本的学生实验,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉,题目难度中等.

 名校课堂系列答案
名校课堂系列答案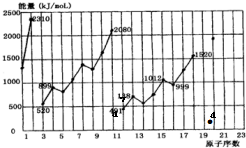 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
a.+99.7kJ•mol-1 b.+29.7kJ•mol-1c.-20.6kJ•mol-1 d.-241.8kJ•mol-1
(2)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示.试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题.
同周期内,随原子序数增大,E值增大.但个别元素的E值出现反常现象.试预测下列关系式中正确的是ac(填写编号,多选倒扣)
a、E(砷)>E(硒)
b、E(砷)<E(硒)
c、E(溴)>E(硒)
d、E(溴)<E(硒)
估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围419<E<738.
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
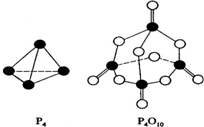
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
下列各项叙述中,表明平衡肯定发生移动的是( )
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
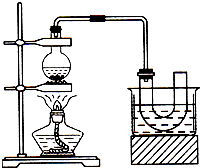 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):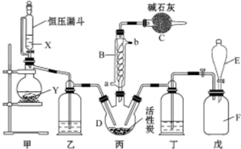 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.