题目内容
2.一定条件下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ/mol,在5L密闭容器中进行,10s时,水蒸气的物质的量增加了0.60mol,则下列说法不正确的是( )| A. | 10s内,NH3的平均反应速率为0.008mol•L-1•s-1 | |
| B. | 该反应达到平衡时6v(O2)正=5v(H2O)逆 | |
| C. | 10s内,反应放出的热量为0.1akJ | |
| D. | 10s时,H2O的反应速率为0.012mol•L-1•s-1 |
分析 10s时水蒸气的物质的量增加了0.60mol,则用水蒸气表示的平均反应速率为:v(H2O)=$\frac{\frac{0.6mol}{5L}}{10s}$=0.012mol•L-1•s-1,
A.根据化学反应速率与化学计量数成正比计算出用氨气表示的平均反应速率;
B.达到平衡时正逆反应速率相等,该关系不满足计量数之比;
C.根据生成0.6mol水蒸气放出akJ热量计算;
D.根据分析判断水的反应速率.
解答 解:10s时水蒸气的物质的量增加了0.60mol,则用水蒸气表示的平均反应速率为:v(H2O)=$\frac{\frac{0.6mol}{5L}}{10s}$=0.012mol•L-1•s-1,
A.10s内,NH3的平均反应速率为:v(NH3)=$\frac{4}{6}$v(H2O)=0.012mol•L-1•s-1×$\frac{4}{6}$=0.008mol•L-1•s-1,故A正确;
B.6v(O2)正=5v(H2O)逆,正逆反应速率相等,达到平衡状态,故B正确;
C.根据4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ/mol可知,生成0.6mol水蒸气放出的热量为:akJ/mol×$\frac{0.6mol}{6}$=0.1akJ,故C正确;
D.根据分析可知,10s内H2O 的平均反应速率为0.012mol?L-1?s-1,并不是10s时的反应速率,故D错误;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学平衡状态的特征及判断方法,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
12. (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
试计算该反应的反应热△H=+125kJ/mol.
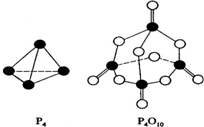
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
根据图示的分子结构和有关数据估算该反应的△H=819kJ•mol-1;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
(2)白磷与氧可发生如下反应:P4(S)+5O2(g)=P4O10(S).已知断裂下列化学键需要吸收的能量分别为如下
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=-195.0kJ•mol-1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol.
13.已知某指定反应物(A)的平衡转化率(α)的数学表达式可用下式表示:α=$\frac{A转化的物质的量}{A的起始物质的量}$×100%
下列各项叙述中,表明平衡肯定发生移动的是( )
下列各项叙述中,表明平衡肯定发生移动的是( )
| A. | 反应混合物的浓度改变 | B. | 反应混合物的压强改变 | ||
| C. | 正、逆反应速率改变 | D. | 反应物的转化率改变 |
10.下列原子中第一电离能最大的是( )
| A. | Be | B. | C | C. | Al | D. | Si |
17.关于粗盐提纯的下列说法中正确的是( )
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |
7.工业上以沙子为原料制取粗硅,主要反应的化学方程式为2C(s)+SiO2(s)=Si (s)+2CO(g)△H>O,对该反应的说法中不正确的是( )
| A. | △S>0 | |
| B. | 产物CO 为酸性氧化物 | |
| C. | 高温条件下才能自发进行 | |
| D. | 采用碎沙而非石块的原因可能是加快反应速率 |
14.能大量共存且溶液为无色透明的离子组是( )
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
12.实验室里用下列仪器和药品制取纯净的无水氯化铜.根据要求完成以下问题:
(1)按气体从左向右流动,装置②在④左边,则②中加入的液体是饱和食盐水;
(2)装置⑤中发生反应的化学方程式是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O;
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻璃管中剩余物呈棕黄色;
(4)某实验小组组装装置时,在①和⑥之间添加了一个盛有浓硫酸的洗气瓶,其作用是防止氢氧化钠溶液中的水蒸气进入装置①.
| 序号 | ① | ② | ③ | ④ | ③ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
(2)装置⑤中发生反应的化学方程式是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2Cl2↑+2H2O;
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻璃管中剩余物呈棕黄色;
(4)某实验小组组装装置时,在①和⑥之间添加了一个盛有浓硫酸的洗气瓶,其作用是防止氢氧化钠溶液中的水蒸气进入装置①.