题目内容
13.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0)某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如下.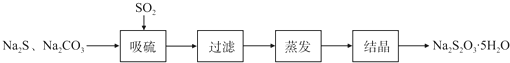
(1)吸硫装置如图所示.
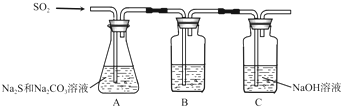
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O 2S2O32-+I2═S4O62-+2I-.
分析 (1)①根据二氧化硫具有还原性、漂白性分析;
②减缓二氧化硫的流速,适当升高温度,均能使二氧化硫充分反应;
(2)①根据检验氯离子的方法分析;
②NaOH的碱性强,可以通过测定pH来确定是否有NaOH;
(3)根据KIO3的量求出I2,再根据S2O32-与I2的关系求出Na2S2O3的物质的量及浓度.
解答 解:(1)①二氧化硫具有还原性、漂白性,所以可以用品红、溴水或KMnO4溶液,来检验二氧化硫是否被完全吸收,若SO2吸收效率低,则二氧化硫有剩余,B中的溶液会褪色,故答案为:品红、溴水或KMnO4溶液;溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,可以减缓二氧化硫的流速,使二氧化硫与溶液充分接触反应,适当升高温度,也能使二氧化硫充分反应,故答案为:控制SO2的流速;适当升高温度;
(2)实验所用的Na2CO3含少量NaCl、NaOH,若检验NaCl存在,需先加稀硝酸排除干扰,再加硝酸银溶液,若有白色沉淀生成,说明有NaCl;已知室温时CaCO3饱和溶液的pH=10.2,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于10.2,说明含有NaOH,
故答案为:
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 有白色沉淀生成 | ||
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. |
(3)KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,I2+2Na2S2O3=Na2S4O6+2NaI;
n(KIO3)=$\frac{a}{214}$mol,设参加反应的Na2S2O3为xmol;
KIO3~~~~3I2~~~~6Na2S2O3
1 6
$\frac{a}{214}$mol xmol
所以 x=$\frac{6a}{214}$mol,则c(Na2S2O3)=$\frac{n}{V}$=$\frac{\frac{6a}{214}mol}{V×1{0}^{-3}L}$=$\frac{6000a}{214V}$mol•L-1,
故答案为:$\frac{6000a}{214V}$.
点评 本题以硫的化合物的性质为载体,考查氧化还原滴定的应用、实验基本操作、化学计算等,难度中等,是对知识的综合运用与分析解决问题能力的考查,注意利用关系式进行计算.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
7.下列表示对应化学反应的离子方程式正确的是( )
| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
1. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
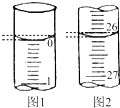
(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
计算所测氢氧化钠溶液的物质的量浓度为0.1044 mol/L(保留四位小数)
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
8. Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果偏小(填“偏大”、“偏小”或“无影响”)
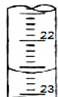
(3)右图是某次滴定时的滴定管中的液面,其读数为22.60mL
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2mol/L
Ⅱ按要求回答下列问题:
(5)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b=10:1
(6)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17.则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:s(AgX)>s(AgY)>s(AgZ);若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减小(填“增大”“减小”或“不变”).
 Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果偏小(填“偏大”、“偏小”或“无影响”)
(3)右图是某次滴定时的滴定管中的液面,其读数为22.60mL
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2mol/L
| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
(5)某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计.若所得混合溶液为中性,则a:b=10:1
(6)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17.则AgX、AgY、AgZ三者的溶解度(mol/L)S(AgX)、S(AgY)、S(AgZ)的大小顺序为:s(AgX)>s(AgY)>s(AgZ);若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减小(填“增大”“减小”或“不变”).
18.某厂用Na 除掉苯中的水分.某次生产误将甲苯当做苯投进反应釜中,由于甲苯中含水量少,最后反应釜还残留大量的Na.下列处理方法更合理、更安全的是( )
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
2.下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(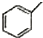 )的一氯代物 )的一氯代物 | D. | 立体烷( 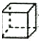 )的二氯代物 )的二氯代物 |
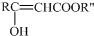
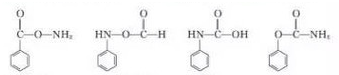
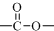 结构;
结构;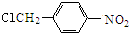 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$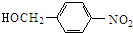 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$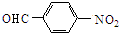
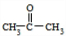 ;E
;E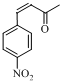
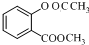 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$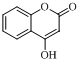 +CH3OH.
+CH3OH.