题目内容
7.下列表示对应化学反应的离子方程式正确的是( )| A. | 钠与CuSO4溶液反应:2Na+Cu=Cu↓+2Na+ | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.钠与硫酸铜溶液反应不会生成铜单质;
B.该反应为可逆反应,且生成的不是沉淀,不能使用沉淀符号;
C.2mol过氧化钠与水反应生成1mol氧气,该反应不满足电子守恒;
D.氢氧化钠少量,反应生成碳酸钙沉淀和水.
解答 解:A.钠与硫酸铜溶液反应生成氢氧化铜沉淀、氢气和硫酸钠,正确的离子反应为:2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑+2Na+,故A错误;
B.明矾溶于水产生Al(OH)3胶体,不能用沉淀符号,正确的离子方程式为:Al3++3H2O?Al(OH)3+3H+,故B错误;
C.Na2O2溶于水产生O2,正确的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故C错误;
D.Cq(HCO3)2溶液与少量NaOH溶液反应的离子方程式为:HCO3-+Ca2++OH-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
17.下列反应中,生成的有机物只有一种的是( )
| A. | 异戊二烯(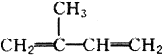 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(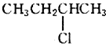 )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 新戊烷和氯气发生取代反应生成一氯取代物的反应 |
18.符合如图阴影部分的物质是( )


| A. | KHSO4 | B. | K2SO4 | C. | K2CO3 | D. | KAl(SO4)2•12H2O |
2.下列有关金属的说法中,正确的是( )
①钠着火可用水扑灭; ②铝在空气中不易被腐蚀,所以铝是不活泼金属; ③生铁在潮湿的空气中可发生吸氧腐蚀; ④人体缺钙会引起骨质疏松、缺铁会引起贫血; ⑤青铜、不锈钢、硬铝都是合金; ⑥Al和Fe在一定条件下能与某些氧化物反应.
①钠着火可用水扑灭; ②铝在空气中不易被腐蚀,所以铝是不活泼金属; ③生铁在潮湿的空气中可发生吸氧腐蚀; ④人体缺钙会引起骨质疏松、缺铁会引起贫血; ⑤青铜、不锈钢、硬铝都是合金; ⑥Al和Fe在一定条件下能与某些氧化物反应.
| A. | ①②⑤ | B. | ②③⑤ | C. | ③④⑤⑥ | D. | 全都正确 |
12.下列各离子组能在强酸性溶液中大量共存的是( )
| A. | K+、Cl-、Fe3+、CO32- | B. | H+、Cl-、ClO-、Ca2+ | ||
| C. | Mg2+、Cl-、NO3-、K+ | D. | K+、ClO-、NO3-、Fe2+ |
19.可逆反应mA(s)+nB(g)?cC(g)+dD(g) 反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )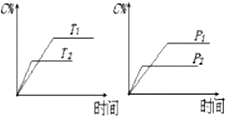

| A. | 达平衡后,加入催化剂则C%增大 | B. | 达平衡后,若升温,平衡左移 | ||
| C. | 化学方程式中n>c+d | D. | 达平衡后,增加A的量平衡向右移动 |
13.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0)某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如下.
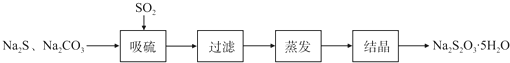
(1)吸硫装置如图所示.
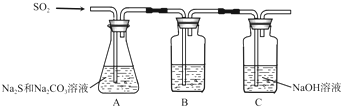
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL.则c(Na2S2O3)=$\frac{6000a}{214V}$mol•L-1.(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O 2S2O32-+I2═S4O62-+2I-.

(1)吸硫装置如图所示.

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O 2S2O32-+I2═S4O62-+2I-.
 .
.