题目内容
5.乙二醛(OHC-CHO)是一种重要的精细化工产品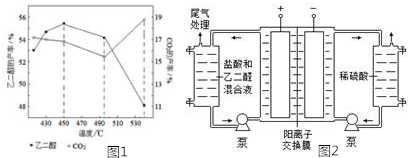
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O.该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是生成的NO会污染空气,硝酸会腐蚀设备.
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)的△H=-406kJ•mol-1.相同温度下,该反应的化学平衡常数K=$\frac{{K}_{2}}{{K}_{1}}$(用含K1、K2的代数式表示).
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图1所示.反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是升高温度,主反应平衡逆向移动、温度超过495℃时,乙二醇大量转化为二氧化碳等副产物.
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图2所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
(3)阴极反应式为2H++2e-=H2↑.
(4)阳极液中盐酸的作用,除了产生氯气外,还有增强溶液导电性.
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=$\frac{5mf}{111at}$%.
(设:法拉第常数为f Cmol-1;η=$\frac{生产目标产物消耗的电子数}{电极上通过的电子总数}$×100% )
分析 (1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO;生成的NO会污染空气,硝酸会腐蚀设备;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),反应热也进行相应计算,平衡常数为反应Ⅱ与Ⅰ的平衡常数的商;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3)阴极是氢离子放电生成氢气;
(4)增强溶液导电性;
(5)通过总电量为60ta C,再计算电极上通过电子总物质的量;计算生成乙醛的物质的量,根据C元素化合价变化计算消耗电子物质的量,电解中的电流效率.
解答 解:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,反应方程式为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O,存在比较明显的缺点是:生成的NO会污染空气,硝酸会腐蚀设备,
故答案为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O;生成的NO会污染空气,硝酸会腐蚀设备;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
Ⅱ.2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),则△H=-484kJ•mol-1-(-78kJ•mol-1)=-406kJ•mol-1,平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K=$\frac{{K}_{2}}{{K}_{1}}$,
故答案为:-406;$\frac{{K}_{2}}{{K}_{1}}$;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,
故答案为:升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3)阴极是氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(4)阳极液中盐酸可以增强溶液导电性,故答案为:增强溶液导电性;
(5)电极通过总电量为60t s×a A=60ta C,则电极上通过电子总物质的量=$\frac{60ta}{f}$mol;生成乙醛酸的物质的量为$\frac{mg}{74g/mol}$=$\frac{m}{74}$mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×$\frac{m}{74}$mol,故电解中的电流效率η=$\frac{2×\frac{m}{74}mol}{\frac{60ta}{f}}$×100%=$\frac{5mf}{111at}$%,故答案为:$\frac{5mf}{111at}$%.
点评 本题考查化学平衡常数计算、运用盖斯定律计算反应热、陌生方程式的书写、电极原理应用等,(5)中计算为易错点,关键是确定C元素化合价变化,可以利用碳元素平均化合价计算,注意电子转移守恒在电化学计算中应用.

| A. | 达平衡后,加入催化剂则C%增大 | B. | 达平衡后,若升温,平衡左移 | ||
| C. | 化学方程式中n>c+d | D. | 达平衡后,增加A的量平衡向右移动 |
(1)吸硫装置如图所示.
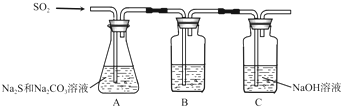
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液颜色很快褪色;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O 2S2O32-+I2═S4O62-+2I-.
 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )| 实验目的 | 试剂 | 试管中的物质 | |
| A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯②苯酚溶液 |
| B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯②甲苯 |
| C | 苯分子中没有碳碳双键 | Br2的CCl2溶液 | ①苯②乙烯 |
| D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
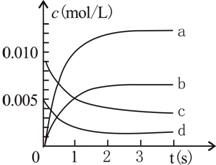 800℃时,在2L密闭容器内加入N0和02,发生反应:2N0(g)+O2(g)?2N02(g),测得n(N0)随时间的变化如表,请回答:
800℃时,在2L密闭容器内加入N0和02,发生反应:2N0(g)+O2(g)?2N02(g),测得n(N0)随时间的变化如表,请回答:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示N02变化的曲线是b;
(3)能说明该反应已达到平衡状态的是ad.
a.容器内气体总物质的量保持不变
b.正反应和逆反应的速率都为0
c.容器内N0、02、N02物质的量之比为2:1:2
d.容器内N0气体的体积分数不变.
| A. | NaCl | B. | MgO | C. | H2SO4 | D. | NaOH |
9.4gX$→_{步骤Ⅰ}^{过量NaOH溶液}$6.4固体$→_{步骤Ⅱ}^{过量盐酸}$蓝色溶液1.92g固体
下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根据步骤Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
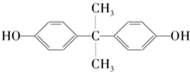 ,生产聚碳酸酯的过程如下:
,生产聚碳酸酯的过程如下: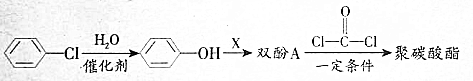
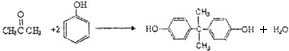 .
.