题目内容
2.某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如表.| 实验1 | 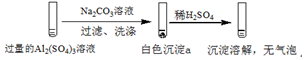 |
| 实验2 | 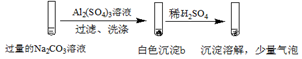 |
| A. | 实验1中,白色沉淀a是Al(OH)3 | |
| B. | 实验2中,白色沉淀b含有CO32- | |
| C. | 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关 | |
| D. | 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液 |
分析 实验1在过量的硫酸铝溶液中加入碳酸钠溶液,过滤、洗涤,得到的沉淀a加入稀硫酸,沉淀溶解,没有气泡,可说明沉淀a含有Al(OH)3,
实验2在过量的碳酸钠溶液中加入硫酸铝溶液,过滤、洗涤,得到沉淀b,加入稀硫酸,沉淀溶解,并有少量气泡,沉淀b中含有Al(OH)3,并含有碳酸盐,以此解答该题.
解答 解:A.由以上分析可知实验1中,白色沉淀a是Al(OH)3,故A正确;
B.实验2中有气泡生成,该气体为二氧化碳,可说明白色沉淀b含有CO32-,故B正确;
C.实验1、2中,加入试剂顺序不同,生成的沉淀的pH不同,生成沉淀不同,可说明与pH有关,故C错误;
D.检验沉淀是否洗涤干净,可通过检验硫酸根离子的方法,即用盐酸酸化的BaCl2溶液,观察是否有沉淀生成,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力的考查,注意把握物质的性质以及实验现象的分析,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
8.不同实验需要使用不同的酸,以下情况中酸的使用合理的是( )
| A. | 焰色反应前用硫酸洗涤铂丝 | |
| B. | 用硫酸干燥Cl2、HCl、CO2、H2 | |
| C. | 用盐酸酸化KMnO4溶液滴入FeSO4溶液,证明Fe2+具有还原性 | |
| D. | 先加硝酸酸化,再加BaCl2溶液检验未知溶液中的SO42-离子 |
9.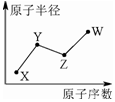 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应生成离子化合物 | |
| C. | 非金属性:Y>Z | |
| D. | X、Z、W形成的化合物均为强酸 |
10.(1)在同一个原子中,离核越近、n越小的能层中的电子能量越低.理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和3d.现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做基态原子.
(2)写出下列基态原子的简化电子排布式:
①14Si1s22s22p63s23p2 或[Ne]3s23p2;②26Fe1s22s22p63s23p63d64s2或[Ar]3d64s2 .
(3)按所示格式填写表中的空格:
(4)N≡N的键能为942kJ•mol-1,N-N单键的键能为247kJ•mol-1,计算说明N2中的π键更稳定(填“σ”或“π”).
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是Fe3+,配离子[Cu(NH3)4]2+的配体是NH3.
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为3,孤电子对数为1,价层电子对数为4,中心原子的杂化方式为sp3杂化,VSEPR构型为四面体形,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面(正)三角形.
(2)写出下列基态原子的简化电子排布式:
①14Si1s22s22p63s23p2 或[Ne]3s23p2;②26Fe1s22s22p63s23p63d64s2或[Ar]3d64s2 .
(3)按所示格式填写表中的空格:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是Fe3+,配离子[Cu(NH3)4]2+的配体是NH3.
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为3,孤电子对数为1,价层电子对数为4,中心原子的杂化方式为sp3杂化,VSEPR构型为四面体形,分子的立体构型为三角锥形.
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面(正)三角形.
7.下列有关说法正确的是( )
| A. | 明矾既可用作净水剂,也可用作消毒剂 | |
| B. | 小苏打、氢氧化铝都可用于治疗胃酸过多 | |
| C. | 煤的干馏、石油的分馏都属于化学变化 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米(1微米=1000纳米)的颗粒物,则PM2.5在空气中能形成胶体 |
14.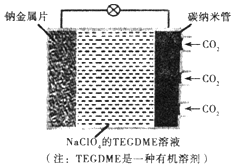 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
 我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )
我国对可呼吸的钠-二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2$?_{充电}^{放电}$2Na2CO2+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中).关于该电池,下列说法错误的是( )| A. | 充电时,Na+从阳极向阴极移动 | |
| B. | 可以用乙醇代替TEGDME做有机溶剂 | |
| C. | 放电时,当转移lmol电子负极质量减轻23g | |
| D. | 放电时,正极反应为3CO2+4Na++4e-=2Na2CO3+C |
11.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图1:
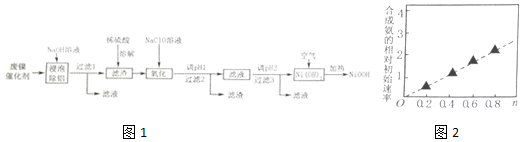
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
“调pH1”时,溶液pH范围为5.6~6.2;过滤2所得滤渣的成分Cr(OH)3和Fe(OH)3(填化学式).
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{充电}^{放电}$MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O;放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).硫酸镍溶液可用于制备合成氨的催化剂ConNi(1-n)Fe2O4.如图2表示在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是Co2+.
(3)“氧化”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;加热\;}}{\;}$4NiOOH+2H2O.
(6)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M$?_{充电}^{放电}$MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O;放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.
12.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y 和Z最外层电子数之和与W的最外层电子数相同.25℃时0.1mol/LX和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | Y和其它四种元素均可形成至少两种化合物(两种元素组成) | |
| B. | 原子半径由大到小排列的顺序是:R>W>Z>Y>X | |
| C. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比均为2:1 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |