题目内容
13. 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应:Ⅰ.BCl3(g)+3H2O(I)=H3BO3(s)+3HCl(g)△H1
Ⅱ.B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2
Ⅲ.H3BO3(aq)+H2O(I)?[B(OH)4]-(aq)+H+(aq)
Ⅳ.H3BO3(I)+3CH3OH(I)?B(OCH3)3(I)+3H2O(I)
(1)已知硼酸的结构是:
 ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
(2)已知△H2>0,既能使反应Ⅱ平衡向正反应方向移动,又能加快反应速率的措施是bc.
a.加压 b.升温 c.增大Cl2的浓度 d.移走部分BCl3 e.加入适当的催化剂 f.增大焦炭的量
(3)写出反应Ⅲ的平衡常数表达式K=$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$;写出阴离子[B(OH)4]-的电子式:
 .
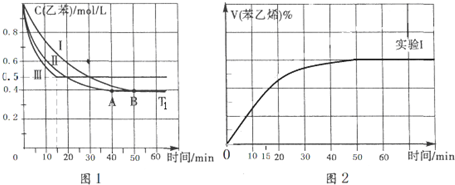
.(4)在反应Ⅳ中,H3BO3的转化率在不同温度下随反应时间(t)的变化如图,若T=333K,初始c(H3BO3)=1mol•L-1,则0~10min的反应速率v(H3BO3)=0.08mol/(L•min);40min达到平衡后,改变温度为T,c(H3BO3 )以0.005mol•L-1•min-1的平均速率降低,经过10min又达到平衡,则T>333K(用“>”、“<”、“=”填空),温度对该反应的速率和平衡移动的影响是升高温度反应速率加快,平衡向正向移动.
分析 (1)根据反应热=反应物总键能-生成物总键能计算;
(2)根据B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2>0即为气体减小的吸热反应,据此分析;(3)化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比;依据硼酸结构简式可知: ,[B(OH)4]-中心元素B连4和-OH,带有一个单位负电荷,据此书写电子式;
,[B(OH)4]-中心元素B连4和-OH,带有一个单位负电荷,据此书写电子式;
(4)依据H3BO3的转化率在不同温度下随反应时间(t)的变化图表可知,若T=333K,H3BO3的转化率为80%,据此计算H3BO3浓度的变化量,依据V=$\frac{△C}{△t}$计算;
升高温度反应速率加快,平衡向吸热方向移动,结合不同温度时H3BO3的转化率大小判断解答.
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H1=3×427kJ.mol-1+6×465kJ.mol-1-(3×431+3×809+3×465)kJ.mol-1=-1044kJ.mol-1;
故答案为:-1044;
(2)由B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2>0即为气体减小的吸热反应,
a.加压平衡逆向移动,故a不选;
b.升温反应速率加快,平衡正向移动,故b选;
c.增大Cl2的浓度,反应速率加快,平衡正向移动,故c选;
d.移走部分BCl3,平衡正向移动,速率减慢,故d不选;
e.加入适当的催化剂反应速率加快,平衡不移动,故e不选;
f.增大焦炭的量,对反应速率和平衡都不产生影响,故f不选;
故选:bc;
(3)H3BO3(aq)+H2O(I)?[B(OH)4]-(aq)+H+(aq)化学平衡常数K=$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$;
依据硼酸结构简式可知 ,[B(OH)4]-中心元素B连4和-OH,带有一个单位负电荷,电子式为
,[B(OH)4]-中心元素B连4和-OH,带有一个单位负电荷,电子式为 ,
,
故答案为:$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$; ;
;
(4)依据H3BO3的转化率在不同温度下随反应时间(t)的变化图表可知,若T=333K,H3BO3的转化率为80%,则H3BO3浓度的变化量为:1mol•L-1×80%=0.8mol/L,0~10min的反应速率v(H3BO3)=$\frac{0.8mol/L}{10min}$=0.08mol/(L•min);
依据:依据H3BO3的转化率在不同温度下随反应时间(t)的变化图表可知,T=333K时H3BO3的转化率,大于T=303K时H3BO3的转化率,说明升高温度,H3BO3的转化率增大,平衡正向移动,所以正向为吸热反应,40min达到平衡后,改变温度为T,c(H3BO3 )以0.005mol•L-1•min-1的平均速率降低,经过10min又达到平衡,说明反应向正向移动,则应为升高温度,T>333K;升高温度反应速率加快;
故答案为:0.08mol/(L•min);>;升高温度反应速率加快,平衡向正向移动.
点评 本题考查了反应热的计算、化学平衡移动、反应速率的影响因素,明确化学键与反应热之间的关系,熟悉影响化学平衡移动的因素,影响反应速率的因素是解题关键,题目难度中等.

| A. |  实验室室制取并收集NH3 | B. |  构成铜锌原电池 | ||
| C. |  检查装置气密性 | D. |  利用排空气法收集CO2 |
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
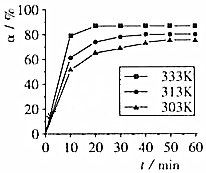
(2)相同条件下,反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=0.375mol•L-1•min-1,
②下列说法不正确的是CE.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
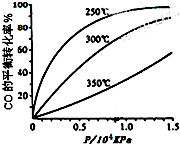
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率
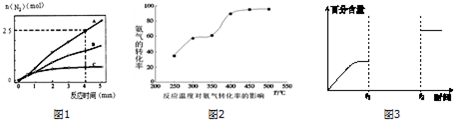
你认为反应控制的最佳温度应为C,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
| A. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O | |
| B. | Cu+4NHO3(浓)=Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→CH2Br-CH2Br | |
| D. | 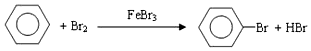 |
| A. | 等于0.6mol | B. | 等于1mol | ||
| C. | 大于0.6mol小于1mol | D. | 小于0.6mol |
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义. +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
?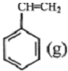 +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol