��Ŀ����
5����֪����ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����H1��Ӧ��2NO��g��+O2��g��?2NO2��g����H2����|��H1|=2|��H2|��
��Ӧ��4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l����H3
��ӦI�͢�Ӧ�ڲ�ͬ�¶�ʱ��ƽ�ⳣ�������С��ϵ�����
| �¶�/K | ��ӦI | ��ӦII | ��֪�� K2��K1��K2�䣾K1�� |
| 298 | K1 | K2 | |
| 398 | K1�� | K2�� |
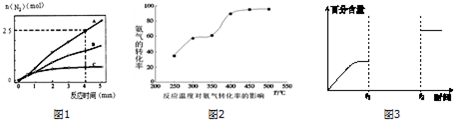
��2����ͬ�����£���ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����2L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ�������Ӧ����N2������ʱ��仯��ͼ1��ʾ��
����0��4������A���������£���Ӧ����V��NO��=0.375mol•L-1•min-1��
������˵������ȷ����CE��
A����λʱ����H-O����N-H�����ѵ���Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
B�����ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵����Ӧ�Ѿ��ﵽƽ��
C���÷�Ӧ�Ļ�ܴ�С˳���ǣ�Ea��A����Ea��B����Ea��C��
D����Ӧ�ﵽƽ��������¶ȣ��淴Ӧ������������С
E������ͼ1��֪������Aʹ��Ӧ���еij̶ȸ���
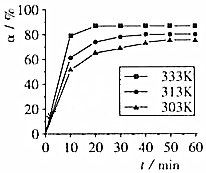
��3����ҵ������β�������У�Ӧ���˷�Ӧ���ԭ������ͼ2��ò�ͬ�¶��°�����ת����
����Ϊ��Ӧ���Ƶ�����¶�ӦΪC��
A��300��350��B��350��400��
C��400��450��D��450��500��
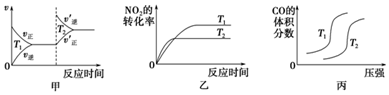
��4��ijһ����̶����ܱ������н��з�Ӧ��200��ʱ��ƽ�⣮������ͼ3���仭����t1ʱ�����£���t1��t2֮��ijʱ�̴ﵽƽ�⣻t2ʱ�����Ӵ�����N2�İٷֺ�����ʱ��仯ͼ��
���� ��1���ٷ�ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����H1��ƽ�ⳣ��K1��K1�䣬����ƽ�ⳣ����С��˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
�ڷ�ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l��K1=$\frac{{c}^{5}��{N}_{2}��}{{c}^{4}��N{H}_{3}��{c}^{6}��NO��}$
��Ӧ��2NO��g��+O2��g��?2NO2��g����K2=$\frac{{c}^{2}��N{O}_{2}��}{{c}^{2}��NO��c��{O}_{2}��}$
150oCʱ����Ӧ��4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l������ƽ�ⳣ������ʽK3=$\frac{{c}^{3}��{O}_{2}��{c}^{5}��{N}_{2}��}{{c}^{4}��N{H}_{3}��{c}^{6}��N{O}_{2}��}$����֪K1��K1�䣬˵�����¶����ߣ�K��С����Ӧ��Ϊ���ȷ�Ӧ����H1��0��K2��K2�䣬˵�����¶����ߣ�K��С����ӦIIΪ���ȷ�Ӧ����H2��0����ӦI-��ӦII��3�õ���ӦIII�����H3=��H1-3��H2���ݴ˷�����
��2����4minʱ����Ϊ2.5mol�������ĵ�NOΪ2.5mol��$\frac{6}{5}$=3mol������v=$\frac{��c}{��t}$����v��NO����
��A�����淴Ӧ����ƽ��ʱ12��O-H���ѣ�ͬʱ����12��O-H����������12��N-H����Ҫ12��N-H���ѣ�
B�����ݾ��ȵ��ܱ������У���Ӧ���¶Ȼ�仯����K��仯����Kֵ����ʱ��˵���¶Ȳ��䣬��Ӧ�Ѿ��ﵽƽ�⣻
C����ͬʱ�������ɵĵ��������ʵ���Խ�࣬��Ӧ����Խ�죬���Խ�ͣ�
D����Ӧ�ﵽƽ��������¶ȣ���������ƽ�����淴Ӧ������У��淴Ӧ���ʴӴ�С��
E�������ı䷴Ӧ���ʣ����ı仯ѧƽ�⣻
��3����ͼ��֪��400-450��ʱ�������ѵ�Ũ����С��ת�������
��4��t1ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ���CO2�İٷֺ������ӣ��ݴ˻�ͼ��
��� �⣺��1���ٷ�ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����H1��ƽ�ⳣ��K1��K1�䣬����ƽ�ⳣ����С��˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
����֪K1��K1�䣬˵�����¶����ߣ�K��С����Ӧ��Ϊ���ȷ�Ӧ����H1��0��K2��K2�䣬˵�����¶����ߣ�K��С����ӦIIΪ���ȷ�Ӧ����H2��0����ӦI-��ӦII��3�õ���ӦIII�����H3=��H1-3��H2����֪|��H1|=2|��H2|�����ԡ�H3=��H1-3��H2=|��H2|��0������ӦIIIΪ���ȷ�Ӧ��150oCʱ����Ӧ��4NH3��g��+6NO2��g��?5N2��g��+3O2��g��+6H2O��l������ƽ�ⳣ������ʽK3=$\frac{{c}^{3}��{O}_{2}��{c}^{5}��{N}_{2}��}{{c}^{4}��N{H}_{3}��{c}^{6}��N{O}_{2}��}$���¶�����ƽ��������У�ƽ�ⳣ������
�ʴ�Ϊ��$\frac{{c}^{3}��{O}_{2}��{c}^{5}��{N}_{2}��}{{c}^{4}��N{H}_{3}��{c}^{6}��N{O}_{2}��}$������
��2����4minʱ����Ϊ2.5mol�������ĵ�NOΪ2.5mol��$\frac{6}{5}$=3mol������v��NO��=$\frac{\frac{3mol}{2L}}{4min}$=0.375mol•L-1•min-1��
�ʴ�Ϊ��0.375mol•L-1•min-1��
��A�����淴Ӧ����ƽ��ʱ12��O-H���ѣ�ͬʱ����12��O-H����������12��N-H����Ҫ12��N-H���ѣ���λʱ����H-O����N-H�����ѵ���Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ�⣬��A��ȷ��
B�����ݾ��ȵ��ܱ������У���Ӧ���¶Ȼ�仯����K��仯����Kֵ����ʱ��˵���¶Ȳ��䣬��Ӧ�Ѿ��ﵽƽ�⣬��B��ȷ��
C����ͬʱ�������ɵĵ��������ʵ���Խ�࣬��Ӧ����Խ�죬���Խ�ͣ��ʻ�ܴ�С˳���ǣ�Ea��A����Ea��B����Ea��C������C����
D����Ӧ�ﵽƽ��������¶ȣ���������ƽ�����淴Ӧ������У��淴Ӧ���ʴӴ�С���淴Ӧ������������С����D��ȷ��
E������ͼ1��֪������A�ı䷴Ӧ���ʣ����ı仯ѧƽ�⣬����ʹ��Ӧ���еij̶ȸ���E��ȷ��
�ʴ�Ϊ��CE��
��3����ͼ��֪��400-450��ʱ�������ѵ�Ũ����С��ת�������ѡC��
�ʴ�Ϊ��C��
��4��t1ʱ�����¶ȣ�ƽ��������Ӧ�����ƶ���CO2�İٷֺ������ӣ�ͼ��Ϊ�� ��
��
��N2�İٷֺ�����ʱ��仯ͼ�� ��
��
���� ���⿼���˻�ѧƽ��Ӱ�����ط����жϡ�ƽ�ⳣ����Ӧ�á���Ӧ���ʼ��㡢ƽ��״̬���жϡ�ͼ����Ϣ����ȡ��Ӧ�õȣ���Ŀ�Ѷ��еȣ������ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ��������

 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�| A�� |  | B�� |  | C�� |  | D�� |  |
| A�� | 100g/mol | B�� | 100g | C�� | 55g/mol | D�� | 55g |
 ���仯�����ڹ�ҵ������ҪӦ�ã���֪���¼�����Ӧ��
���仯�����ڹ�ҵ������ҪӦ�ã���֪���¼�����Ӧ����BCl3��g��+3H2O��I��=H3BO3��s��+3HCl��g����H1
��B2O3��s��+3C��s��+3Cl2��g��?2BCl3��g��+3CO��g����H2
��H3BO3��aq��+H2O��I��?[B��OH��4]-��aq��+H+��aq��
����H3BO3��I��+3CH3OH��I��?B��OCH3��3��I��+3H2O��I��
��1����֪����Ľṹ�ǣ�
 ����Ӧ������ػ�ѧ�������������£�
����Ӧ������ػ�ѧ�������������£�| ��ѧ�� | H-O | H-Cl | B-O | B-Cl |
| E��KJ•mol-1�� | 465 | 431 | 809 | 427 |
��2����֪��H2��0������ʹ��Ӧ��ƽ��������Ӧ�����ƶ������ܼӿ췴Ӧ���ʵĴ�ʩ��bc��
a����ѹ b������ c������Cl2��Ũ�� d�����߲���BCl3 e�������ʵ��Ĵ��� f������̿����
��3��д����Ӧ���ƽ�ⳣ������ʽK=$\frac{[[B��OH��{\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$��д��������[B��OH��4]-�ĵ���ʽ��
 ��
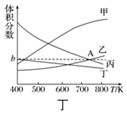
����4���ڷ�Ӧ���У�H3BO3��ת�����ڲ�ͬ�¶����淴Ӧʱ�䣨t���ı仯��ͼ����T=333K����ʼc��H3BO3��=1mol•L-1����0��10min�ķ�Ӧ����v��H3BO3��=0.08mol/��L•min����40min�ﵽƽ��ı��¶�ΪT��c��H3BO3 ����0.005mol•L-1•min-1��ƽ�����ʽ��ͣ�����10min�ִﵽƽ�⣬��T��333K���á�����������������=����գ����¶ȶԸ÷�Ӧ�����ʺ�ƽ���ƶ���Ӱ���������¶ȷ�Ӧ���ʼӿ죬ƽ���������ƶ���
��1�����ڸ÷�Ӧ��4CO��g��+2NO2��g��?4CO2��g��+N2��g����H=-1 200kJ•mol-1���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ�����ң�����ţ���
�÷�Ӧ��ƽ�ⳣ������ʽΪK=$\frac{{c}^{4}��C{O}_{2}��c��{N}_{2}��}{{c}^{4}��CO��{c}^{2}��N{O}_{2}��}$��
��2������β����CO��H2O��g����һ�������¿��Է�����Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0.820��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
���������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת����������ƽ�ⳣ��K�������������С�����䡱����
��3��Ϊ���������ܼ��š��͡���̼���á���Ŀǰ��ҵ����һ�ַ�������CO2������ȼ���Ҵ���һ�������·�����Ӧ��2CO2��g��+6H2��g��?CH3CH2OH��g��+3H2O��g����H��0����һ�������£���20L�ܱ������а����ʵ�����Ϊ1��3����CO2��H2���¶���450K��5MPa�²��ƽ����ϵ�и����ʵ�����������¶ȵı仯������ͼ����ʾ�������ұ�ʾ����CO2�������ʵĻ�ѧʽ�������������ͼ����A���Ӧ���������b=18.8%�����������λ��Ч���֣���
| A�� | K+��H+��SO42-��OH- | B�� | Na+��Ca2+��CO32-��NO3- | ||
| C�� | Na+��Cu2+��SO42-��Cl- | D�� | Na+��H+��Cl-��CO32- |
| A�� | �þƾ���ȡ��ˮ�еĵ� | |
| B�� | ��Һʱ����Һ©���е�����Һ������¿ڷų� | |
| C�� | ����ʱ��Ӧ���¶ȼ�ˮ����������ƿ֧�ܿڴ� | |
| D�� | ����NaOH����ʱ�����������ƹ������������ƽ���̵�ֽ�� |
| A�� | 431kJ•mol-1 | B�� | 649kJ•mol-1 | C�� | 896kJ•mol-1 | D�� | 946kJ•mol-1 |
 ��
��