题目内容
8.工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯的反应: +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H其中乙苯在CO2气氛中的反应可分两步进行:
A.
 ?
?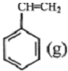 +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/molB.H2(g)+CO2(g)?CO(g)+H2O(l)△H2=-85kJ/mol
(1)上述乙苯与CO2反应的反应热△H=-210KJ/mol.
(2)下列叙述不能说明乙苯与CO2反应已达到平衡状态的是bc.
a.恒温恒压时气体密度不变 b.C(CO2)=C(CO)
c.消耗1molCO2同时生成 1molH2O d.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2发生反应.在三种不同的条件下进行实验,乙苯、CO2的起始浓度均分别为1mol/L和3mol/L,其中实验I在T1.C、P1 Pa下,而实验II、III分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图1所示.
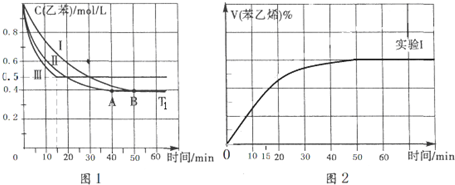
①实验I乙苯在0-50min时的反应速率为0.012mol/(L•min).
②实验Ⅱ可能改变条件的是加入催化剂.
③图2是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)实验I达到平衡后,在该温度下,向该容器中再通入乙苯和CO2各1mol,重新达到平衡时,乙苯的转化率将减小(填“增大”、“减小”或“不变”),此时平衡常数为0.375.
分析 (1)根据盖斯定律将方程A+方程B得到热化学方程式;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(3)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
(4)平衡由于温度没变K值不变,用原平衡I计算:K=$\frac{0.6×0.6}{0.4×2.4}$=0.375.
解答 解:(1)方程A+方程B得到: ,所以该反应的反应热为:△H=△H1+△H2=-125-85=-210KJ/mol,
,所以该反应的反应热为:△H=△H1+△H2=-125-85=-210KJ/mol,
故答案为:-210KJ/mol;
(2)a.反应前后体积不等不变,如密度不变,说明体积不变,可说明达到平衡状态,故a正确;
b.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故b错误;
c.消耗1molCO2为正速率,同时生成1molH2O也是正速率,都是正速率,二者始终相等,不能说明已经达到平衡状态,故c错误;
d.随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故d正确;
所以不能说明已达到平衡状态的是bc,
故答案为:b c;
(3)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则其反应速率为$\frac{△c}{△t}$=$\frac{0.6mol/L}{50min}$=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,故答案为:加入催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡向着逆向移动,所以苯乙烯体积分数V%随时间t增大而减小,则实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线为 ,故答案为:
,故答案为: ;
;
(4)再通入CO2和乙苯各1mol,相当于减少二氧化碳的量,平衡逆向移动,重新达到平衡时,乙苯的转化率将减少;平衡由于温度没变K值不变,用原平衡I计算:K=$\frac{0.6×0.6}{0.4×2.4}$=0.375,
故答案为:减小; 0.375.
点评 本题考查了化学平衡影响因素、化学平衡常数的计算等知识,题目难度中等,注意掌握化学平衡及其影响因素,明确化学平衡常数、化学反应速率的概念及计算方法;(4)中平衡常数的计算依据图I中的实验1分析计算.

 阅读快车系列答案
阅读快车系列答案| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 硫化钠的水解:S2-+2H2O?H2S+2OH- | |
| C. | 向Fe(NO3)3溶液中加入过量的HI溶液:Fe3++3NO3-+10I-+12H+=5I2+Fe2++3NO↑+6H2O | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
| A. | 100g/mol | B. | 100g | C. | 55g/mol | D. | 55g |
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
(1)该反应的K值表达式为$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)体积不变的条件下,下列措施中有利于提高CO产率的是AB(填字母).
A.升高温度 B.降低压强 C.增加C用量 D.通入H2
(3)某温度下,四种容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如表所示.请填写表中相应的空格①和②.
| 容器编号 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
(5)已知:C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283.0kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8kJ/mol
那么,将2.4g炭完全转化为水蒸气,然后再燃烧,整个过程△H=-78.7kJ/mol.
 硼及其化合物在工业中有重要应用,已知以下几个反应:
硼及其化合物在工业中有重要应用,已知以下几个反应:Ⅰ.BCl3(g)+3H2O(I)=H3BO3(s)+3HCl(g)△H1
Ⅱ.B2O3(s)+3C(s)+3Cl2(g)?2BCl3(g)+3CO(g)△H2
Ⅲ.H3BO3(aq)+H2O(I)?[B(OH)4]-(aq)+H+(aq)
Ⅳ.H3BO3(I)+3CH3OH(I)?B(OCH3)3(I)+3H2O(I)
(1)已知硼酸的结构是:
 ,反应Ⅰ中相关化学键键能数据如下:
,反应Ⅰ中相关化学键键能数据如下:| 化学键 | H-O | H-Cl | B-O | B-Cl |
| E(KJ•mol-1) | 465 | 431 | 809 | 427 |
(2)已知△H2>0,既能使反应Ⅱ平衡向正反应方向移动,又能加快反应速率的措施是bc.
a.加压 b.升温 c.增大Cl2的浓度 d.移走部分BCl3 e.加入适当的催化剂 f.增大焦炭的量
(3)写出反应Ⅲ的平衡常数表达式K=$\frac{[[B(OH){\;}_{4}]{\;}^{-}][H{\;}^{+}]}{[{H}_{3}B{O}_{3}]}$;写出阴离子[B(OH)4]-的电子式:
 .
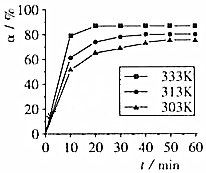
.(4)在反应Ⅳ中,H3BO3的转化率在不同温度下随反应时间(t)的变化如图,若T=333K,初始c(H3BO3)=1mol•L-1,则0~10min的反应速率v(H3BO3)=0.08mol/(L•min);40min达到平衡后,改变温度为T,c(H3BO3 )以0.005mol•L-1•min-1的平均速率降低,经过10min又达到平衡,则T>333K(用“>”、“<”、“=”填空),温度对该反应的速率和平衡移动的影响是升高温度反应速率加快,平衡向正向移动.
(1)对于该反应:4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1 200kJ•mol-1,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
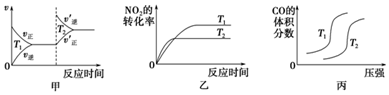
该反应的平衡常数表达式为K=$\frac{{c}^{4}(C{O}_{2})c({N}_{2})}{{c}^{4}(CO){c}^{2}(N{O}_{2})}$.
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
②乙容器中,通过改变温度,使CO的平衡转化率增大,则平衡常数K增大(填“增大”、“减小”或“不变”).
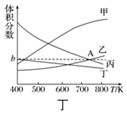
(3)为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图丁所示.曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| C. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处 | |
| D. | 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上 |
 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题: