题目内容
3.金属的腐蚀是指金属与周围接触到的气体或液体物质发生氧化还原反应而引起损耗的现象.金属腐蚀的本质是金属失去电子变为阳离子,发生氧化反应.一般可分为化学腐蚀和电化学腐蚀.分析 根据金属的腐蚀的概念来回答;金属腐蚀的本质是金属失去电子被氧化;根据金属腐蚀的类型分为电化学腐蚀、化学腐蚀来回答.
解答 解:金属的腐蚀是指金属与周围接触到的空气或液体发生氧化还原反应而引起损耗的现象;金属腐蚀的本质是金属失去电子变成阳离子而被氧化;金属腐蚀的类型包括电化学腐蚀和化学腐蚀,故答案为:氧化还原反; 金属失去电子变成阳离子; 氧化;化学; 电化学.
点评 本题考查学生金属的腐蚀和防护知识,注意原电池和电解池工作原理的应用是关键,难度不大.

练习册系列答案
相关题目
13.下列关于氯水的叙述,不正确的是( )
| A. | 氯水应保存在棕色瓶中,久置的氯水,pH值减小 | |
| B. | 新制饱和氯水中存在4个平衡 | |
| C. | 在一定浓度的氯水中加小苏打,$\frac{c(HClO)}{c(C{l}^{-})}$不变 | |
| D. | 饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
14. 将等物质的量浓度的Cu(NO3)2和KCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是( )
将等物质的量浓度的Cu(NO3)2和KCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是( )
 将等物质的量浓度的Cu(NO3)2和KCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是( )
将等物质的量浓度的Cu(NO3)2和KCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是( )| A. | AB段阳极只产生Cl2,阴极只产生Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段相当于电解水 | |
| D. | 阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2 |
11.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 任何条件下,等质量的氧气和臭氧(O3)所含的原子数必相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
18.下列属于温室气体的是( )
| A. | O2 | B. | CO | C. | N2 | D. | CO2 |
12.下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C-H键:413.4kJ/mol、H-H键:436.0kJ/mol.则下列叙述正确的是( )
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A. | CH4(g)+2O2(g)═CO2 (g)+2 H2O ( l)△H=-890.3 kJ/mol | |
| B. | 质量相等的CH4比C2H2燃烧放出热量少 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ/mol |
13.下列关于热化学反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |

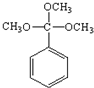 .
. .
.