题目内容
14. 将等物质的量浓度的Cu(NO3)2和KCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是( )
将等物质的量浓度的Cu(NO3)2和KCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法错误的是( )| A. | AB段阳极只产生Cl2,阴极只产生Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段相当于电解水 | |
| D. | 阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2 |
分析 设CuSO4的和KCl各n mol,
AB段:阳极发生2Cl--2e-═Cl2↑,阴极发生Cu2++2e-═Cu,nmol氯离子失n mol电子,阴极上$\frac{1}{2}$nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极发生2H2O-4e-═4H++O2↑,阴极发生Cu2++2e-═Cu,阴极上$\frac{1}{2}$n mol铜离子再得nmol电子,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极发生4OH--4e-═2H2O+O2↑,阴极发生2H++2e-═H2↑,实质是电解水,溶液中氢离子浓度逐渐增大,pH值减小.
解答 解:设CuSO4的和KCl各n mol,
AB段:阳极发生2Cl--2e-═Cl2↑,阴极发生Cu2++2e-═Cu,nmol氯离子失n mol电子,阴极上$\frac{1}{2}$nmol铜离子得nmol电子,由于铜离子水解使溶液酸性减弱,铜离子浓度逐渐减小,溶液pH值逐渐增大;
BC段:阳极发生2H2O-4e-═4H++O2↑,阴极发生Cu2++2e-═Cu,阴极上$\frac{1}{2}$n mol铜离子再得nmol电子,溶液中氢离子浓度增大,溶液的pH值迅速减小;
CD段:阳极发生4OH--4e-═2H2O+O2↑,阴极发生2H++2e-═H2↑,实质是电解水,溶液中氢离子浓度逐渐增大,pH值减小.
A.由上述分析可知,AB段阳极只产生Cl2,阴极只产生Cu,故A正确;
B.BC段表示在阴极上电极反应式为:Cu2++2e-═Cu,故B错误;
C.CD段发生2H++2e-═H2↑、4OH--4e-═2H2O+O2↑,即CD段电解的物质是水,故C正确;
D.由上述分析可知,阳极先析出Cl2,后析出O2,阴极先产生Cu,后析出H2,故D正确,
故选:B.
点评 本题考查电解原理,明确电解过程中离子的移动及离子的放电顺序、发生的电极反应是解答本题的关键,并注意结合图象来分析解答,题目难度中等.

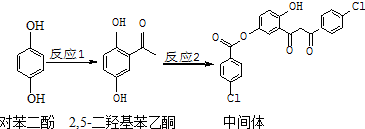
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
| A. | 27g铝与足量的盐酸或NaOH溶液反应,转移电子的数目均为3NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为10NA | |
| C. | 22.4 L氨气中含有N-H键的个数为3NA | |
| D. | Fe与水蒸气在高温条件下反应,有1mol Fe参与反应,则转移电子的数目为3NA |

| A. | 用装置A分离乙酸和乙酸乙酯 | B. | 用装置B收集NO气体 | ||
| C. | 用装罝C在实验室中制取氨气 | D. | 用装置D除去Cl2中的HC1 |
| A. | 原子序数为55 | B. | 电子数是55 | C. | 中子数是137 | D. | 质量数是137 |
①铝合金门窗耐腐蚀 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金.
| A. | ①③④ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤ |
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.4mol•L-1 | D. | 0.8mol•L-1 |
| A. | 减少对大气的污染 | B. | 降低成本 | ||
| C. | 防止石油短缺 | D. | 加大发动机的动力 |