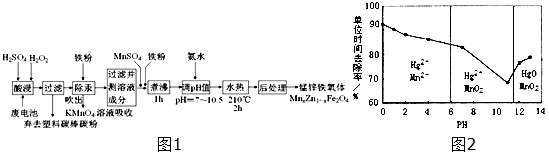
题目内容
12.下表中列出了25℃、101kPa时一些物质的燃烧热数据| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A. | CH4(g)+2O2(g)═CO2 (g)+2 H2O ( l)△H=-890.3 kJ/mol | |
| B. | 质量相等的CH4比C2H2燃烧放出热量少 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ/mol |
分析 A、燃烧热是1mol可燃物燃烧放出的热量;
B、1molCH4放出热量890.3kJ,也就16gCH4放出热量890.3kJ,1molC2H2放出热量1299.6kJ也就是26g放出热量为:1299.6kJ;
C.依据化学反应的焓变=反应物总键能-生成物的总键能;
D.2CH4(g)═C2H2(g)+3H2(g)为吸热反应,△H>0.
解答 解:A、燃烧热是1mol可燃物燃烧放出的热量,所以 CH4(g)+2O2(g)═CO2 (g)+2 H2O ( l)△H=-890.3 kJ/mol,故A正确;
B、1molCH4放出热量890.3kJ,也就16gCH4放出热量890.3kJ,1molC2H2放出热量1299.6kJ也就是26g放出热量为:1299.6kJ,设质量为16×26g,所以等质量放出热量大小为890.3kJ×26=23147.8KJ,而16×26gC2H2放出热量1299.6kJ×16=20793.6kJ,所以质量相等的CH4比C2H2燃烧放出热量多,故B错误;
C.氢气燃烧热为285.8kJ/mol,热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,则2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故C错误;
D.由A可知:C2H2(g)+3H2(g)═2CH4(g)△H=-376.4 kJ/mol,则 2CH4(g)═C2H2(g)+3H2(g)△H=+376.4 kJ•mol-1,故D错误;
故选:A.
点评 本题主要考查了燃烧热的应用,掌握燃烧热的定义和盖斯定律的运用是解答本题的关键,题目难度中等.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
| A. | 用装置A分离乙酸和乙酸乙酯 | B. | 用装置B收集NO气体 | ||
| C. | 用装罝C在实验室中制取氨气 | D. | 用装置D除去Cl2中的HC1 |
| A. | 有白色沉淀生成 | |
| B. | 有红棕色沉淀生成 | |
| C. | 没有沉淀生成 | |
| D. | 既有红褐色沉淀生成又有无色气体产生 |
| A. | 钠浮在水面上,四处游动 | |
| B. | 反应放出的热量使得钠熔化成一个小球 | |
| C. | 反应完后烧杯中有蓝色不溶物 | |
| D. | 反应完后烧杯中出现红色不溶物 |
| A. | 减少对大气的污染 | B. | 降低成本 | ||
| C. | 防止石油短缺 | D. | 加大发动机的动力 |
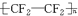 .
. .
.