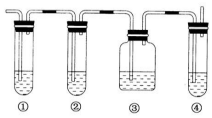
题目内容
4.下列各组中的离子,能在溶液中大量共存的是( )| A. | Na+、H+、Cl-、HCO3- | B. | K+、Fe3+、NO3-、SO42- | ||
| C. | Ca2+、H+、C1-、OH- | D. | Na+、Ba2+、CO32-、NO3- |
分析 A.氢离子与碳酸氢根离子反应;
B.四种离子之间不反应,能够共存;
C.氢离子、钙离子与氢氧根离子反应;
D. 钡离子与碳酸根离子反应生成碳酸钡沉淀.
解答 解:A.H+、HCO3-之间发生反应,在溶液中不能大量共存,故A错误;
B.K+、Fe3+、NO3-、SO42-之间不反应,在溶液中能够大量共存,故B正确;
C.Ca2+、H+与OH-之间发生反应,在溶液中不能大量共存,故C错误;
D.Ba2+、CO32-之间反应生成难溶物碳酸钡,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
14.实验室需用到900mL0.1mol/L的稀盐酸,拟用量筒取用9mol/L的浓盐酸在容量瓶中进行配制.下列有关说法正确的是( )
| A. | 应量取的浓盐酸的体积是10.0mL | |
| B. | 若开始时洁净的容量瓶中有少许蒸馏水,对实验没有影响 | |
| C. | 量取浓盐酸时,因浓盐酸有挥发性,所以要多量取lmL浓盐酸 | |
| D. | 定容摇匀后,发现液面低于刻度线,应立即加少量蒸馏水补至刻度线 |
12.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 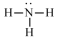 氨分子的结构式 | B. | 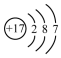 Cl-结构示意图 | C. | 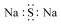 Na2S的电子式 | D. | 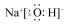 NaOH的电子式 |
19.下列各组中的离子,能在溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、CO32-、Cl- | D. | Na+、Cu2+、Cl-、SO42- |
9.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | NaHCO3溶液中:c (CO32-)+c(H+)=c(H2CO3)+c(OH-) | |
| C. | 1 L 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
16.下列气体中是非电解质,且和SO2一起通入到BaCl2溶液中可生成BaSO3沉淀的是( )
| A. | Cl2 | B. | H2S | C. | NH3 | D. | HCl |
13.实验需要配制KMnO4溶液,下列操作会引起所配溶液浓度偏大的是( )
| A. | 容量瓶用蒸馏水洗涤后未干燥即用来配制溶液 | |
| B. | 定容时,观察液面俯视刻度线 | |
| C. | 摇匀后,液面低于刻度线,没有再加蒸馏水 | |
| D. | 用蒸馏水洗涤烧杯和玻璃棒.并将洗涤液转移入容量瓶中 |
14.下列说法正确的是( )
| A. | “物质的量”是衡量物质重量的物理量 | |
| B. | 氢氧化钠的摩尔质量是40g | |
| C. | 物质的量浓度的常用单位是mol•L-1 | |
| D. | 1mol任何物质所占有的体积都是22.4L |
 的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是
的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是 .
.