题目内容
16.下列气体中是非电解质,且和SO2一起通入到BaCl2溶液中可生成BaSO3沉淀的是( )| A. | Cl2 | B. | H2S | C. | NH3 | D. | HCl |
分析 能够和SO2一起通入到BaCl2溶液中生成BaSO3沉淀,必须生成亚硫酸根离子,据此分析.
解答 解:A、氯气和SO2一起通入到BaCl2溶液中可生成BaSO4沉淀,且氯气不是电解质,故A错误;
B、H2S是电解质,但和SO2一起通入到BaCl2溶液中可生成S沉淀,故B错误;
C、NH3是非电解质且是碱性气体和SO2一起通入到BaCl2溶液中可生成BaSO3沉淀,故C正确;
D、HCl是电解质且和SO2一起通入到BaCl2溶液中,没有沉淀生成,故D错误;
故选C.
点评 本题考查了电解质和非电解质的相关概念以及溶液中的离子反应,题目难度不大,注意基本概念的了解.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
6.Na2S2O3•5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3•5H2O晶体析出.该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质.为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
(1)样品与硫酸可能发生反应的离子方程式为S2O32-+2H+=S↓+SO2↑+H2O、SO32-+2H+=SO2↑+H2O.
(2)根据上表数据分析,该样品A(填选项字母)
A.含有Na2S2O3、Na2SO3和Na2SO4三种成分
B.含有Na2S2O3和Na2SO3两种成分
C.只含有Na2S2O3
(3)求第三份样品中各成分的物质的量.
(4)求所加硫酸的物质的量浓度.
(5)若将63g该样品与一定量的该硫酸溶液微热,回答问题:
①欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位)硫酸溶液的体积.当a=0.06时,V(SO2)=5.6;
②(2分)在图1上画出b随a变化的曲线
(6)图2是实验室制取SO2并验证SO2的某些性质的装置图.
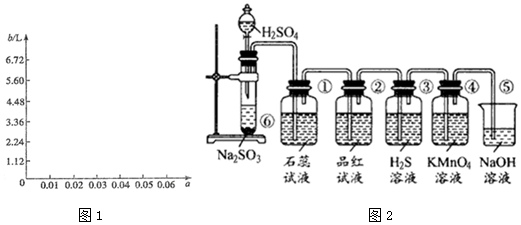
试回答:
Ⅰ.实验中应该选择浓硫酸,是否使用98%的浓H2SO4否(填“是”或“否”),写出⑥中反应化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑.
Ⅱ.①中的实验现象为变红.
Ⅲ.②中的现象证明SO2具有的化学性质为漂白性.
Ⅳ.③中的实验现象是变浑浊(生成淡黄色沉淀),证明SO2有氧化性.
Ⅴ.④中的实验现象是紫红色褪去,证明SO2有还原性.
Ⅵ.⑤的作用是吸收多余的SO2,防止污染空气.
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.98 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
(2)根据上表数据分析,该样品A(填选项字母)
A.含有Na2S2O3、Na2SO3和Na2SO4三种成分
B.含有Na2S2O3和Na2SO3两种成分
C.只含有Na2S2O3
(3)求第三份样品中各成分的物质的量.
(4)求所加硫酸的物质的量浓度.
(5)若将63g该样品与一定量的该硫酸溶液微热,回答问题:
①欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位)硫酸溶液的体积.当a=0.06时,V(SO2)=5.6;
②(2分)在图1上画出b随a变化的曲线
(6)图2是实验室制取SO2并验证SO2的某些性质的装置图.

试回答:
Ⅰ.实验中应该选择浓硫酸,是否使用98%的浓H2SO4否(填“是”或“否”),写出⑥中反应化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑.
Ⅱ.①中的实验现象为变红.
Ⅲ.②中的现象证明SO2具有的化学性质为漂白性.
Ⅳ.③中的实验现象是变浑浊(生成淡黄色沉淀),证明SO2有氧化性.
Ⅴ.④中的实验现象是紫红色褪去,证明SO2有还原性.
Ⅵ.⑤的作用是吸收多余的SO2,防止污染空气.
7.能证明氯化钠的是离子化合物的实验事实是( )
| A. | .氯化钠的水溶液能够导电 | B. | .氯化钠晶体中只存在离子键 | ||
| C. | .熔融的氯化钠可以导电 | D. | 氯化钠的熔沸点比较高 |
4.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Fe3+、NO3-、SO42- | ||
| C. | Ca2+、H+、C1-、OH- | D. | Na+、Ba2+、CO32-、NO3- |
11.下列离子方程式正确的是( )
| A. | 向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
1.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mL Cl2,恰好将Fe2+完全氧化.下列说法正确的是( )
| A. | FexO溶于足量盐酸后只生成了FeCl3和H2O | |
| B. | 标准状况下112 mL Cl2的物质的量是5 mol | |
| C. | x=0.8 | |
| D. | 通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl- |
8.当溶液中X2O72-和SO32-的离子数之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价为
( )
( )
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
5.下列叙述中不正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| B. | 用瓷坩埚加热熔化氢氧化钠固体 | |
| C. | 向BaCl2溶液中通入SO2,溶液不变浑浊,再入CO2,溶液仍不变浑浊 | |
| D. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 |
6.对图两种化合物的结构或性质描述正确的是( )
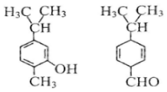

| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原了数相同 | |
| C. | 含氧官能团的性质不同 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |