题目内容
14.下列说法正确的是( )| A. | “物质的量”是衡量物质重量的物理量 | |
| B. | 氢氧化钠的摩尔质量是40g | |
| C. | 物质的量浓度的常用单位是mol•L-1 | |
| D. | 1mol任何物质所占有的体积都是22.4L |
分析 A.物质的量描述的是含有一定数目粒子的集体,不是物质重量;
B.摩尔质量的单位为g/mol;
C.物质的量浓度的符号为c,单位为mol/L;
D.物质的体积与物质状态及温度、压强有关.
解答 解:A.物质的量为国际单位制中七个基本物理量之一,描述含有一定数目粒子的集体,不是物质的重量,故A错误;
B.氢氧化钠的摩尔质量为40g/mol,故B错误;
C.物质的量浓度c=$\frac{n}{V}$,则其浓度为mol/L,故C正确;
D.1mol物质的体积不一定为22.4L,若为气体,温度和压强都影响气体体积,若为固体和液态,物质体积取决于粒子间距离,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量的概念及使用方法为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
4.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Fe3+、NO3-、SO42- | ||
| C. | Ca2+、H+、C1-、OH- | D. | Na+、Ba2+、CO32-、NO3- |
5.下列叙述中不正确的是( )
| A. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| B. | 用瓷坩埚加热熔化氢氧化钠固体 | |
| C. | 向BaCl2溶液中通入SO2,溶液不变浑浊,再入CO2,溶液仍不变浑浊 | |
| D. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 |
2.对于化工生产中的化学反应,既要考虑反应的限度和快慢,还要综合考虑成本、设备等因素.
工业制硫酸的重要的一步反应是:2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)在不增加反应物的前提下,从理论上考虑,既能加快反应速率,又能提高SO2转化率的条件是增大压强.
(2)实际生产中的条件是:500℃、催化剂(V2O2),1标准大气压并不断鼓入空气.
①采用500℃的目的是催化剂活性最大.
②用平衡移动原理解释生产过程中不断鼓入空气的目的增大二氧化硫的转化率.
③下表是500℃,不同压强时SO2转化率的变化情况:
请结合表中信息说明采用1标准大气压而不采用更高压强的原因:常压时的转化率较高、高压成本高.
工业制硫酸的重要的一步反应是:2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)在不增加反应物的前提下,从理论上考虑,既能加快反应速率,又能提高SO2转化率的条件是增大压强.
(2)实际生产中的条件是:500℃、催化剂(V2O2),1标准大气压并不断鼓入空气.
①采用500℃的目的是催化剂活性最大.
②用平衡移动原理解释生产过程中不断鼓入空气的目的增大二氧化硫的转化率.
③下表是500℃,不同压强时SO2转化率的变化情况:
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
9.下列物质与水反应生成强碱的是( )
| A. | Na2O | B. | SO3 | C. | CO2 | D. | NH3 |
6.对图两种化合物的结构或性质描述正确的是( )
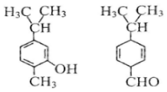

| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原了数相同 | |
| C. | 含氧官能团的性质不同 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
8.实现下列变化时,必须克服相同类型作用的是( )
| A. | 二氧化硅和冰的熔化 | B. | 氯化钠和铁的熔化 | ||
| C. | 烧碱和金刚石的熔化 | D. | 碘和干冰的升华 |