题目内容
12.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )| A. | 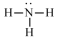 氨分子的结构式 | B. | 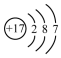 Cl-结构示意图 | C. | 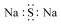 Na2S的电子式 | D. | 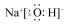 NaOH的电子式 |
分析 A.结构式,为成键电子对不需要标出;
B.氯离子最外层8个电子;
C.硫化钠为离子化合物,2个钠离子与硫离子通过离子键结合;
D.氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合.
解答 解:A.氨气分子中氮原子与三个氢原子通过N-H键结合,结构式为: ,故A错误;
,故A错误;
B.氯元素是17号元素,故氯离子的核内质子数为17,当核电荷数=质子数<核外电子数,为阴离子,结构示意图为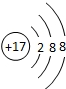 ,故B错误;
,故B错误;
C.硫化钠为离子化合物,2个钠离子与硫离子通过离子键结合,电子式: ,故C错误;
,故C错误;
D.氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合,电子式: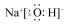 ,故D正确;
,故D正确;
故选:D.
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

练习册系列答案
相关题目
2.铜钱在历史上曾经是一种广泛流通的货币.从物理性质和化学性质的角度分析,铜常用于制造货币的说法正确的是( )
| A. | 铜来源广泛,易于从自然界冶炼得到 | |
| B. | 铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型 | |
| C. | 铜的外观为紫红色,大方美观,易于被人们接受 | |
| D. | 铜的化学性质不稳定,在空气中易转化为铜绿,铜绿具有抗腐蚀能力,易于流通 |
7.能证明氯化钠的是离子化合物的实验事实是( )
| A. | .氯化钠的水溶液能够导电 | B. | .氯化钠晶体中只存在离子键 | ||
| C. | .熔融的氯化钠可以导电 | D. | 氯化钠的熔沸点比较高 |
17.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:NaH>H2O>H2S | D. | 硬度:SiC>石墨>CaCO3 |
4.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Fe3+、NO3-、SO42- | ||
| C. | Ca2+、H+、C1-、OH- | D. | Na+、Ba2+、CO32-、NO3- |
1.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mL Cl2,恰好将Fe2+完全氧化.下列说法正确的是( )
| A. | FexO溶于足量盐酸后只生成了FeCl3和H2O | |
| B. | 标准状况下112 mL Cl2的物质的量是5 mol | |
| C. | x=0.8 | |
| D. | 通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl- |
2.对于化工生产中的化学反应,既要考虑反应的限度和快慢,还要综合考虑成本、设备等因素.
工业制硫酸的重要的一步反应是:2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)在不增加反应物的前提下,从理论上考虑,既能加快反应速率,又能提高SO2转化率的条件是增大压强.
(2)实际生产中的条件是:500℃、催化剂(V2O2),1标准大气压并不断鼓入空气.
①采用500℃的目的是催化剂活性最大.
②用平衡移动原理解释生产过程中不断鼓入空气的目的增大二氧化硫的转化率.
③下表是500℃,不同压强时SO2转化率的变化情况:
请结合表中信息说明采用1标准大气压而不采用更高压强的原因:常压时的转化率较高、高压成本高.
工业制硫酸的重要的一步反应是:2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)在不增加反应物的前提下,从理论上考虑,既能加快反应速率,又能提高SO2转化率的条件是增大压强.
(2)实际生产中的条件是:500℃、催化剂(V2O2),1标准大气压并不断鼓入空气.
①采用500℃的目的是催化剂活性最大.
②用平衡移动原理解释生产过程中不断鼓入空气的目的增大二氧化硫的转化率.
③下表是500℃,不同压强时SO2转化率的变化情况:
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
 ,COS属于极性分子(填“极性”或“非极性”).
,COS属于极性分子(填“极性”或“非极性”).