题目内容
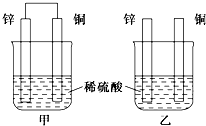 将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:(1)下列说法中正确的是
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中H+的浓度均减小
(2)在相同时间内,两烧杯中产生气泡的速率:甲
(3)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol?L-1.试确定原稀硫酸的物质的量浓度为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
(2)作原电池负极的金属加速被腐蚀;
(3)根据氢气和转移电子之间的关系式计算;
(4)根据硫酸中氢离子的物质的量结合公式进行计算即可.
(2)作原电池负极的金属加速被腐蚀;
(3)根据氢气和转移电子之间的关系式计算;
(4)根据硫酸中氢离子的物质的量结合公式进行计算即可.
解答:
解:(1)A、甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A错误;
B、乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C、甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D、两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故选:BD;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
(3)甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=
=×2=0.1mol,通过导线的电子数目为0.1NA或6.02×1022,
故答案为:0.1NA或6.02×1022;
(4)当乙中产生1.12L(标准状况)即0.05mol氢气气体时,根据2H+~H2↑,则消耗的氢离子物质的量是0.1mol,剩余的氢离子是0.1mol,所以氢离子的物质的量是0.2mol,硫酸的物质的量是0.1mol,原稀硫酸的物质的量浓度为
=1.0mol/L,故答案为:1.0mol/L.
B、乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C、甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D、两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故选:BD;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
(3)甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=
| 1.12L |
| 22.4L/mol |
故答案为:0.1NA或6.02×1022;
(4)当乙中产生1.12L(标准状况)即0.05mol氢气气体时,根据2H+~H2↑,则消耗的氢离子物质的量是0.1mol,剩余的氢离子是0.1mol,所以氢离子的物质的量是0.2mol,硫酸的物质的量是0.1mol,原稀硫酸的物质的量浓度为
| 0.1mol |
| 0.1L |
点评:本题考查了原电池原理,明确正负极上发生的电极反应是解本题关键,根据电极反应式来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,三种难溶银盐的Ksp与颜色如表,下列说法正确的是( )
| AgCl | Ag2CrO4 | AgI | |
| 颜色 | 白 | 砖红 | 黄 |
| Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
| A、AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减弱 |
| B、Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol?L-1 |
| C、向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色 |
| D、向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀 |
下列说法中错误的是( )
| A、熔融状态下能够导电的化合物中一定存在离子键 |
| B、单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |
| C、L层上的电子数为奇数的原子一定是主族元素的原子 |
| D、同一主族的元素的原子,最外层电子数相同,化学性质不一定完全相同 |
NA代表阿伏加德罗常数.下列有关NA的叙述中,正确的是( )
| A、1mol任何物质所含的分子数均为NA |
| B、14g氮气所含的氮原子数为NA |
| C、标准状况下,22.4L水所含的水分子数为NA |
| D、在钠与氯气的反应中,1mol钠失去电子的数目为2NA |
能正确表示下列反应的离子方程式是( )
A、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)
| ||||||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||||||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→ 2C6H5OH+2CO32- | ||||||
| D、甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O |
下列离子方程式的书写正确的是( )
| A、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、NaHCO3溶液与NaOH溶液反应:OHˉ+HCO3ˉ═CO32ˉ+H2O |
| C、钠和冷水反应:Na+2H2O═Na++2OHˉ+H2↑ |
| D、氯气通入水中:Cl2+H2O═2H++Clˉ+ClOˉ |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kj/molNa202(s)+CO2(g)=Na2C03(s)+
02(g)△H=-226kj/mol 下列表述正确的是(NA代表阿伏伽德罗常数的数值)( )
| 1 |
| 2 |
| A、lmolCO燃烧时放出的热量为283 kJ/mol |
| B、Na2O2和Na2C03中阴阳离子个数比不同 |
| C、Na202(s)与CO2(g)反应放出226kJ热量时电子转移数为2NA |
| D、Na202(s)+CO(g)=Na2C03(s)△H=-509 kJhnol |


