题目内容
下列离子方程式的书写正确的是( )
| A、铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、NaHCO3溶液与NaOH溶液反应:OHˉ+HCO3ˉ═CO32ˉ+H2O |
| C、钠和冷水反应:Na+2H2O═Na++2OHˉ+H2↑ |
| D、氯气通入水中:Cl2+H2O═2H++Clˉ+ClOˉ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.不符合反应的客观事实;
B.NaHCO3溶液与NaOH溶液反应生成碳酸钠和水;
C.电荷不守恒;
D.次氯酸为弱电解质,保留化学式.
B.NaHCO3溶液与NaOH溶液反应生成碳酸钠和水;
C.电荷不守恒;
D.次氯酸为弱电解质,保留化学式.
解答:
解:A.铁和稀硫酸反应生成亚铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.NaHCO3溶液与NaOH溶液反应,离子方程式:OHˉ+HCO3ˉ═CO32ˉ+H2O,故B正确;
C.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OHˉ+H2↑,故C错误;
D.氯气通入水中,离子方程式:Cl2+H2O═H++Cl-+HClO,故D错误;
故选:B.
B.NaHCO3溶液与NaOH溶液反应,离子方程式:OHˉ+HCO3ˉ═CO32ˉ+H2O,故B正确;
C.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OHˉ+H2↑,故C错误;
D.氯气通入水中,离子方程式:Cl2+H2O═H++Cl-+HClO,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子方程式应遵循客观规律、遵循原子个数、电荷数守恒规律,注意化学式的拆分.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列叙述不正确的是( )
| A、铜具有良好的导电性,常用来制作印刷电路板 |
| B、硅和二氧化硅都是重要的半导体材料 |
| C、铝制品不宜长时间盛放酸性或碱性食物 |
| D、氯水和过氧化钠都具有漂白作用,其漂白原理相同 |
下列关于金属腐蚀的叙述不正确的是( )
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、与生铁相比纯铁更容易被腐蚀 |
| C、金属的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀 |
| D、金属腐蚀的本质是M-ne?=Mn+ |
运用盖斯定律可方便地计算出难以通过实验直接测定的反应热.已知:
P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJ?mol-1
P(红磷,s)+
O2(g)=
P4O10(s)△H=-738.5kJ?mol-1
则白磷转化为红磷的热化学方程式为( )
P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJ?mol-1
P(红磷,s)+
| 5 |
| 4 |
| 1 |
| 4 |
则白磷转化为红磷的热化学方程式为( )
| A、P4(白磷,s)=4P(红磷,s)△H=-29.2kJ?mol-1 |
| B、P4(白磷,s)=4P(红磷,s)△H=+29.2kJ?mol-1 |
| C、P4(白磷,s)=4P(红磷,s)△H=-2244.7kJ?mol-1 |
| D、P4(白磷,s)=4P(红磷,s)△H=+2244.7kJ?mol-1 |
雌黄与浓硝酸反应如下:As2S3+28HNO3(浓)?2H3As04+3H2S04+28N02↑+8H2O,下列说法正确的是( )
| A、氧化产物只有H2S04 |
| B、1mol As2S3发生反应,有28 mol电子转移 |
| C、该反应中As2S3既是氧化剂又是还原剂 |
| D、As2S3不可能与氧气反应 |
在标准状况下,将O2与NO按3:4的体积比充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升后,最后烧瓶内溶液的物质的量浓度为( )
| A、0.045mol?L-1 |
| B、0.036mol?L-1 |
| C、0.026mol?L-1 |
| D、0.030mol?L-1 |
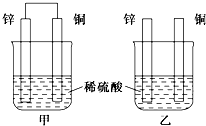 将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
 )(用反应流程图表示).
)(用反应流程图表示).