题目内容
能正确表示下列反应的离子方程式是( )
A、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)
| ||||||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||||||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→ 2C6H5OH+2CO32- | ||||||
| D、甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.乙醛具有还原性,能够被银氨溶液氧化生成乙酸铵;
B.卤代烃在碱性环境下发生取代反应;
C.苯酚钠溶液中通入少量的CO2反应生成碳酸氢钠和苯酚;
D.氨基酸为两性物质,与碱反应生成盐和水.
B.卤代烃在碱性环境下发生取代反应;
C.苯酚钠溶液中通入少量的CO2反应生成碳酸氢钠和苯酚;
D.氨基酸为两性物质,与碱反应生成盐和水.
解答:
解:A.用银氨溶液检验乙醛的醛基,离子方程式:CH3CHO+2Ag(NH3)2++2OH-
CH3COO-+NH4++3NH3+2Ag↓+H2O,故A正确;
B.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,离子方程式:CH2BrCOOH+2OH-
CH2(OH)COO-+H2O+Br-,故B错误;
C.向苯酚钠溶液中通入少量的CO2,离子方程式:CO2+H2O+C6H5O-→ C6H5OH+HCO3-,故C错误;
D.甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应,离子方程式:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O,故D正确;
故选:AD.
| 水浴加热 |
B.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,离子方程式:CH2BrCOOH+2OH-
| △ |
C.向苯酚钠溶液中通入少量的CO2,离子方程式:CO2+H2O+C6H5O-→ C6H5OH+HCO3-,故C错误;
D.甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应,离子方程式:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O,故D正确;
故选:AD.
点评:本题考查了离子方程式,侧重考查有机物参加的离子反应,熟悉物质的结构和性质是解题关键,题目难度中等.

练习册系列答案
相关题目
 向20.OOmLO.lmol?L-1的NaOH溶液中逐滴加入0.lOOmol.L-1 CH3COOH溶液,滴定曲线如图,下列有关叙述正确的是( )
向20.OOmLO.lmol?L-1的NaOH溶液中逐滴加入0.lOOmol.L-1 CH3COOH溶液,滴定曲线如图,下列有关叙述正确的是( )| A、0.lOOmol?L-1的CH3COOH溶液的pH=l |
| B、如图a=7 |
| C、当V<20.00mL时,溶液中离子浓度的大小关系可能为:c(CH3CO0-)>c(Na+)>(OH-)>c(H+) |
| D、当V=20.00mL时.有c(CH3COO-)+c(CH3COOH)=c(Na+) |
 25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )| A、同浓度的NaA与NaB溶液中,c(A-) 小于c(B-) |
| B、a点溶液的导电性大于b点溶液 |
| C、a点的c(HA)大于b点的c(HB) |
| D、HA 的酸性强于HB |
设NA为阿伏加德罗常数,下列叙述正确的是( )
| A、80gNH4NO3 中含有氮原子数为2NA |
| B、1Llmol?L-1盐酸中含有氯化氢分子数为NA |
| C、标准状况下,11.2LCCl4 所含分子数为0.5NA |
| D、铁在氯气中燃烧,1lmolFe失去的电子数为2NA |
下列反应过程中的能量变化符合如图情况的是( )


| A、酸与碱的中和反应 |
| B、Ba(OH)2?8H2O与NH4Cl的反应 |
| C、镁和盐酸的反应 |
| D、酒精燃烧 |
短周期主族元素A、B、C、D,原子半径依次减小,其中A的单质是一种重要的半导体材料;B的单质常用于自来水消毒;C是金属,其密度是所有金属中最小;D的一种气态氢化物能使湿润的红色石蕊试纸变蓝.则下列说法错误的是( )
| A、D的气态氢化物比A的气态氢化物稳定 |
| B、A的常见氧化物是一种酸性氧化物,能与水反应生成一种弱酸 |
| C、B的最高价氧化物对应的水化物是酸性最强的含氧酸 |
| D、单质C常温下能与水反应生成一种气体 |
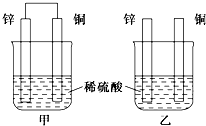 将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: