题目内容
4.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如表.| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g•L-1 |
| 排放标准 | pH 6~9 | 0.5mg•L-1 |
回答以下问题:
(1)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)最大是5.7×10-17mol•L-1.
(2)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(3)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH到2,再投入适量生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②在pH调节到8左右才开始出现大量Ca3(AsO4)2沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
分析 (1)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,由表格中Ksp可知Ksp(FeAsO4 )最小,以此计算;
(2)入MnO2先将其氧化成五价砷(H3AsO4弱酸)同时生成Mn2+和H2O;
(3)①硫酸钙难溶于酸,所以酸性条件下能析出;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大.
解答 解:(1)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,由表格中Ksp可知Ksp(FeAsO4 )最小,反应过程中Fe3+先析出沉淀,Ksp(FeAsO4 )=c(Fe3+)c(AsO43-)=5.7×10-21,Fe3+的浓度均为1.0×10-4mol•L-1,则 c(AsO43-)=$\frac{5.7×1{0}^{-21}}{1×1{0}^{-4}}$=5.7×10-17mol/L,
故答案为:5.7×10-17;
(2)三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸)同时生成Mn2+和H2O,则该反应的离子方程式为2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O,
故答案为:2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O;
(3)①硫酸钙难溶于酸,所以酸性条件下能析出,因此pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4,故答案为:CaSO4;
②H3AsO4是弱酸电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀,
故答案为:H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的应用及计算、习题中的信息为解答的关键,侧重分析与计算能力的考查,注意多元弱酸的电离,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | NaOH(强碱) | B. | CO2(氧化物) | C. | H2SO4(弱酸) | D. | 盐酸(混合物) |
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.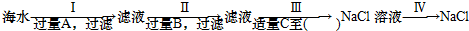
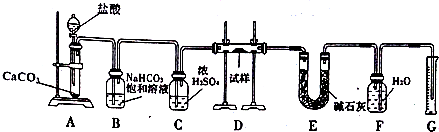
 .
.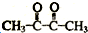 ,A→B的反应类型为氧化反应.
,A→B的反应类型为氧化反应.