题目内容
15.现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量).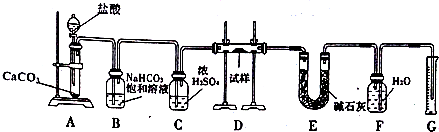
回答下列问题:
(1)装置B的作用是除去气体中的HCl;装置C的作用是干燥气体;装置E中碱石灰的作用是吸收装置D中反应剩余的二氧化碳.
(2)装置D中发生反应的化学方程式是:Na2O+CO2=Na2CO3,2Na2O2+2CO2=2Na2CO3+O2.
(3)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为78%.
分析 根据实验装置图可知,测定Na2O2试样的纯度,先在A中用碳酸钙与盐酸反应生成二氧化碳,二氧化碳中含有氯化氢和水蒸气,影响实验的结果,所以用B装置除去氯化氢,用C装置干燥二氧化碳,再在D装置中与样品中的过氧化钠反应生成 氧气,用E装置除去氧气中未反应的二氧化碳,F、G装置用排水量气法测得生成的氧气的体积,根据氧气的体积可计算出样品中含有的过氧化钠的质量,进而确定Na2O2试样的纯度,
(1)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(2)装置D中是过氧化钠和二氧化碳反生成碳酸钠和氧气,氧化钠和二氧化碳反应生成碳酸钠;
(3)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度
解答 解:根据实验装置图可知,测定Na2O2试样的纯度,先在A中用碳酸钙与盐酸反应生成二氧化碳,二氧化碳中含有氯化氢和水蒸气,影响实验的结果,所以用B装置除去氯化氢,用C装置干燥二氧化碳,再在D装置中与样品中的过氧化钠反应生成 氧气,用E装置除去氧气中未反应的二氧化碳,F、G装置用排水量气法测得生成的氧气的体积,根据氧气的体积可计算出样品中含有的过氧化钠的质量,进而确定Na2O2试样的纯度,
(1)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;干燥气体;吸收装置D中反应剩余的二氧化碳;
(2)装置D中是过氧化钠和二氧化碳反生成碳酸钠和氧气,氧化钠和二氧化碳反应生成碳酸钠,反应的化学方程式为:Na2O+CO2=Na2CO3,
2Na2O2+2CO2=2Na2CO3+O2,
故答案为:Na2O+CO2=Na2CO3,2Na2O2+2CO2=2Na2CO3+O2;
(3)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,
过氧化钠的纯度=$\frac{0.02mol×78g/mol}{2.0g}$×100%=78%,故答案为:78%.
点评 本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强,答题时注意运用常见的元素化合物知识对实验装置的分析,题目难度中等.

| A. | 1mol H2的质量只有在标准状况下才约为2g | |
| B. | 标准状况下,22.4L氖气含有的原子数为2NA | |
| C. | 标准状况下,18g水的体积约为22.4L | |
| D. | 同温同压下,相同体积的气体单质含有的原子数目不一定相等 |
| A. | 气体分子数均为3.01×1022 | B. | 密度相等 | ||
| C. | 原子数相等 | D. | 电子数相等 |
| A. |  制备及收集乙烯 | B. |  石油分馏 | ||
| C. |  实验室制硝基苯 | D. |  石蜡油的催化裂化 |
 我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )
我国自行设计和生产的电动燃料汽车,该车装有“绿色心脏”--质子交换膜燃料电池,其工作原理如图所示.则下列叙述正确的( )| A. | 通入O2的电极发生氧化反应 | |
| B. | 通入H2的电极是正极 | |
| C. | 正极的电极反应为O2+4H++4e-═2H2O | |
| D. | 总反应的化学方程式为:O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g•L-1 |
| 排放标准 | pH 6~9 | 0.5mg•L-1 |
回答以下问题:
(1)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)最大是5.7×10-17mol•L-1.
(2)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(3)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH到2,再投入适量生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②在pH调节到8左右才开始出现大量Ca3(AsO4)2沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合气体的平均相对分子质量$\overline{M}$不再随时间变化的反应达到平衡状态 | |
| B. | 15.0℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3 | |
| C. | 该反应△H>0,p2=2p1 | |
| D. | 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 |
 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: