题目内容
6.随着经济的不断发展,人们对环境问题也越来越关注.(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是ad(填字母).
a.苯 b.甲烷 c.醋酸 d.甲醛
(2)下列措施中,有利于降低室内污染物浓度的是abcd(填字母).
a.勤开窗通风 b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料 d.室内放一些活性碳
(3)“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决温室效应的有效途径,将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
b.CO2+3H2$\stackrel{催化剂}{→}$CH3OH+H2O
c.CO2+CH4$\stackrel{催化剂}{→}$CH3COOH
d.2CO2+6H2$\stackrel{催化剂}{→}$CH2═CH2+4H2O
以上反应中,最节能的是a,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是c.
(4)氟氯代烷(商品名氟利昂)曾被广泛用作制冷剂、灭火剂、溶剂等,因氯、溴的氟代烷对臭氧层产生破坏作用而被禁止、限制使用.
(5)“汽车尾气污染”已倍受世人关注.以辛烷(C8H18)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占$\frac{1}{5}$体积)的体积比(相同条件下)为0.016(保留三位小数).
分析 (1)甲烷、乙烯、醋酸不具有毒性,苯为有毒易挥发液体;
(2)a.勤开窗通风,能够使室内有毒气体排除;
b.日常生活中利用天然气替代煤作燃料,减少有毒物质的排放;
c.使用“绿色环保”装饰材料,减少有毒物质的排放;
d.室内放一些活性碳,能够吸附有毒物质;
(3)依据反应的条件和反应方程式特点解答;
(4)氟利昂进入大气层,能够消耗臭氧,破坏臭氧层;
(5)依据1molC8H18完全燃烧消耗12.5mol氧气结合空气中O2占$\frac{1}{5}$体积计算a值.
解答 解:(1)甲烷、醋酸不具有毒性,苯为有毒易挥发液体,甲醛为有害物质,可致癌,属于室内挥发性有机污染物,故选:ad;
(2)a.勤开窗通风,能够使室内有毒气体排除;
b.日常生活中利用天然气替代煤作燃料,减少有毒物质的排放;
c.使用“绿色环保”装饰材料,减少有毒物质的排放;
d.室内放一些活性碳,能够吸附有毒物质;
都能起到降低室内污染物浓度,
故选:abcd;
(3)反应a在光合作用下进行,耗能最少,c中反应物原子全部转化为生成物,原子利用率最高;
故答案为:a;c;
(4)氟利昂进入大气层,能够消耗臭氧,破坏臭氧层;
故答案为:臭氧层;
(5)1molC8H18完全燃烧消耗12.5mol氧气,则1体积C8H18完全燃烧消耗12.5体积氧气,需要空气的体积为12.5×5=62.5,a=$\frac{1}{62.5}$=0.016,
故答案为:0.016.
点评 本题考查了环境的污染与防护,为高频考点,侧重于化学与环境、生活的考查,熟悉物臭氧空洞和臭氧层保护的知识及常见有机物的性质是解题关键,题目难度不大,注意对相关知识的积累.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g•L-1 |
| 排放标准 | pH 6~9 | 0.5mg•L-1 |
回答以下问题:
(1)若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)最大是5.7×10-17mol•L-1.
(2)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(3)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH到2,再投入适量生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②在pH调节到8左右才开始出现大量Ca3(AsO4)2沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合气体的平均相对分子质量$\overline{M}$不再随时间变化的反应达到平衡状态 | |
| B. | 15.0℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3 | |
| C. | 该反应△H>0,p2=2p1 | |
| D. | 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 |
| A. | S(s)+O2(g)═SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2的键能总和大于1 mol硫和1 mol氧气的键能之和 | |
| D. | 1 mol SO2的键能总和小于1 mol硫和1 mol氧气的键能之和 |
| A. | 1mol酸与1mol碱完全反应放出的热量就是中和热 | |
| B. | 如果反应在加热时才能发生,则该反应是吸热反应 | |
| C. | 反应物总能量大于生成物总能量,则反应的△H<0 | |
| D. | 强酸强碱中和热的离子方程式可表示为:H+(aq)+OH-(aq)═H2O(l)△H=57.3 kJ/mol |
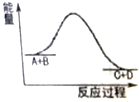
| A. | 该反应为吸热反应 | |
| B. | 该反应只有在加热的条件下才能进行 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应物中的化学键断裂要放出热量 |
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
| A. | .质子数等于电子数的某微粒,可能是一种分子或一种离子 | |
| B. | 只由一种分子组成的物质一定为纯净物 | |
| C. | 3517Cl与3717Cl互为同位素 | |
| D. | 1molNa2O2晶体与1molNa2O晶体中所含阴阳离子总数相等 |
| A. | 浓硫酸、水 | B. | 饱和食盐水、浓H2SO4 | ||
| C. | 烧碱、石灰水 | D. | 无水CaCl2、烧碱 |