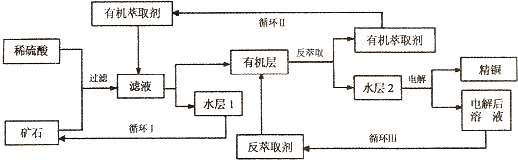
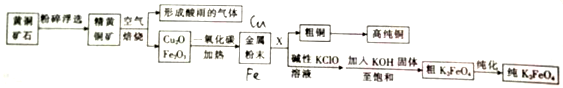
题目内容
9.常温下,某溶液中水电离产生的H+浓度为1×10-9 mol•L-1,则该溶液中含有的溶质( )| A. | 只能是酸 | B. | 只能是碱 | ||
| C. | 可能是酸也可能是碱 | D. | 只能是盐 |
分析 常温下,纯水中水电离产生的H+浓度为1×10-7mol•L-1,而现在某溶液中水电离产生的H+浓度为1×10-9 mol•L-1,说明在此溶液中,水的电离被抑制,而酸、碱和强酸强碱的酸式盐均能抑制水的电离,盐类的水解能促进水的电离,据此分析.
解答 解:常温下,纯水中水电离产生的H+浓度为1×10-7mol•L-1,而现在某溶液中水电离产生的H+浓度为1×10-9 mol•L-1,说明在此溶液中,水的电离被抑制,而酸、碱和强酸强碱的酸式盐均能抑制水的电离,盐类的水解能促进水的电离.
A、可能是酸,但不一定是酸,故A错误;
B、可能是碱,但不一定是碱,故B错误;
C、可能是酸也可能是碱,还可能是强酸强碱的酸式盐,故C正确;
D、可能是强酸强碱的酸式盐,但不一定是盐,故D错误.
故选C.
点评 本题考查了酸碱对水的电离的抑制、盐类的水解对水的电离的促进,应注意的是若为强酸强碱的酸式盐,则也能抑制水的电离.

练习册系列答案
相关题目
19.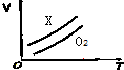 如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
 如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示ag O2与a gX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C3H6(气) | B. | CH4 | C. | CO2 | D. | NO |
17.下列过程或现象与盐类水解无关的是( )
| A. | 纯碱溶液去油污 | B. | 明矾可作净水剂 | ||
| C. | 加热氯化铁溶液颜色变深 | D. | 硫酸氢钠溶液显酸性 |
4.有以下仪器:托盘天平、烧杯、漏斗、锥形瓶、药匙、玻璃杯、量筒、酸碱滴定管、铁架台、胶头滴管、容量瓶、环形玻璃搅拌棒,从仪器角度看,不能够完成的实验是( )
| A. | 中和热测定 | B. | 中和滴定 | ||
| C. | 过滤 | D. | 物质的量浓度溶液配制 |
14.已知反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A. | 平衡前,充入氮气,容器内压强增大,反应速率加快 | |
| B. | 平衡时,其他条件不变,分离出硫,逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度可提高 SO2 的转化率 | |
| D. | 其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变 |
1.1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)?bZ(g) 反应达到平衡后,测得X的转化率为50%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则a和b的数值可能是( )
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
18.A、B、C、D、E为原子序数依次增大的短周期主族元素,A与C、B与D分别同主族,且A、C元素的质子数之和是B、D元素质子数之和的一半.下列判断正确的是( )
| A. | 原子半径大小顺序:D>C>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含有共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最低的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |