题目内容
1.1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)?bZ(g) 反应达到平衡后,测得X的转化率为50%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则a和b的数值可能是( )| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
分析 依据化学平衡三段式列式计算各组分平衡时物质的量,同温同压下,密度之比和气体体积成反比,即和气体物质的量成反比,据此结合选项讨论判断a、b的取值.
解答 解:1mol X气体跟a mol Y气体在体积可变的密闭容器中反应,反应达到平衡后,测得X的转化率为50%,则参加反应的X为0.5mol,则:
X(g)+a Y(g)?b Z(g)
起始量(mol):1 a 0
变化量(mol):0.5 0.5a 0.5b
平衡量(mol):0.5 0.5a 0.5b
同温同压下,气体总质量不变,反应前后混合气体的密度之比和气体体积成反比,即和气体物质的量成反比,反应前混合气体的密度是反应后混合气体密度的$\frac{3}{4}$,则反应前气体物质的量是反应后气体物质的量$\frac{4}{3}$,则(1+a):(0.5+0.5a+0.5b)=4:3,整理得:2b=a+1,
若a=1,则b=1,若a=2,则b=1.5,若a=3,则b=2,B、C、D不符合,只有D符合,
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确同温同压下混合气体密度之比和气体物质的量成反比是计算关键,注意掌握化学平衡特征及应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
11.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学分别设计了不同的方法,其中不可行的是( )
| A. | 将少量的两种白色固体分别加入1 mol/L的盐酸中,看有无气泡产生 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加BaCl2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
12.四种短周期元素A、B、C、D的性质或结构信息如下.
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题.
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为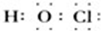 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
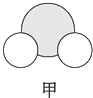 | 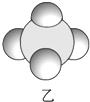 |  |
| 是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
(1)甲、乙、丙中含有的共同元素是氢(填名称).
(2)B元素在周期表中的位置为第2周期ⅣA族.
(3)上述元素的原子M层有一个未成对p电子的是Cl(填元素符号).
(4)丙的电子式为
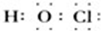 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为HClO+H2O+SO2=H2SO4+HCl.
9.常温下,某溶液中水电离产生的H+浓度为1×10-9 mol•L-1,则该溶液中含有的溶质( )
| A. | 只能是酸 | B. | 只能是碱 | ||
| C. | 可能是酸也可能是碱 | D. | 只能是盐 |
16.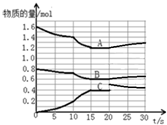 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
6.下列溶液中Cl-的物质的量最大的是( )
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
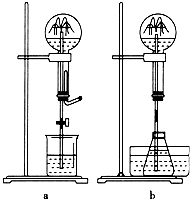 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.