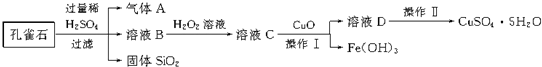
题目内容
12.以黄铜矿(主要成分为FeCuS2)为原料制备铜和高铁酸钾(K2FeO4),其生产流程如下: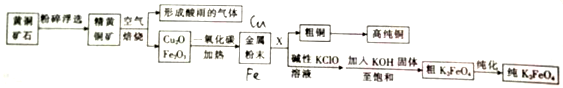
(1)黄铜矿石浮选时要将矿石粉碎的理由是使矿石在煅烧时能被空气充分氧化.
(2)黄铜矿在空气中焙烧的化学方程式2FeCuS2+O2$\frac{\underline{\;高温\;}}{\;}$Fe2O3+4SO2+2CuO.
(3)Cu2O与稀硫酸反应时既表现出氧化性又表现出还原性,Cu2O与稀硫酸反应的离子方程式为Cu2O+2H+=Cu+Cu2++H2O.
(4)试剂X可能是B (填字母).
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.浓硫酸
(5)为了充分自用资源,变废为宝,用足量Ca(OH)2悬浊液吸收形成酸雨的气体,生成固体的化学式为CaSO3,然后再用硫酸处理该固体,得到的高浓度气体用于制备硫酸.
(6)在工业上,一般利用亚铬酸钾(KCrO2)氧化还原滴定法来确定高铁酸钾的纯度,其原理如下:在强碱性溶液中,高铁酸钾将亚铬酸钾氧化为铬酸钾(K2CrO4),生成的铬酸钾酸化后形成重铬酸钾(K2Cr2O7),再用亚铁离子滴定生成的重铬酸钾,现称取1.980g粗高铁酸钾样品溶于适量KOH溶液中,加入稍过量的KCrO2,充分反应[K2FeO4转化为Fe(OH)3]后过滤,滤液定容于250mL容量瓶中.取25.00mL滤液,加入稀硫酸酸化,用0.10mol•L-1的(NH4)2Fe(SO4)2标准溶液滴定,记录数据,然后重复滴定两次并算出消耗标准溶液的平均体积为18.93mL,则上述样品中高铁酸钾的质量分数为63.1%.
分析 根据流程图,黄铜矿(主要成分为FeCuS2)进行粉碎浮选,便于在空气中与空气充分反应,在空气中被氧化成黄铜矿氧化铁和氧化铜固体及二氧化硫气体,二氧化硫能形成酸雨,氧化铜和氧化铁的混合物被一氧化碳还原得金属粉末是铜和铁的混合物,将铜和铁的混合物溶于稀硫酸,过滤可得粗铜,经过精制可得精铜,滤液中含有硫酸亚铁,在次氯酸钠的碱性溶液中被氧化成高铁酸钠,再加入氢氧化钾至饱和,可生成高铁酸钾晶体,经纯化可得纯高铁酸钾,据此答题;
解答 解:根据流程图,黄铜矿(主要成分为FeCuS2)进行粉碎浮选,便于在空气中与空气充分反应,在空气中被氧化成黄铜矿氧化铁和氧化铜固体及二氧化硫气体,二氧化硫能形成酸雨,氧化铜和氧化铁的混合物被一氧化碳还原得金属粉末是铜和铁的混合物,将铜和铁的混合物溶于稀硫酸,过滤可得粗铜,经过精制可得精铜,滤液中含有硫酸亚铁,在次氯酸钠的碱性溶液中被氧化成高铁酸钠,再加入氢氧化钾至饱和,可生成高铁酸钾晶体,经纯化可得纯高铁酸钾,
(1)将矿石粉碎可以增大矿石与空气的接触面积,使矿石在煅烧时能被空气充分氧化,
故答案为:使矿石在煅烧时能被空气充分氧化;
(2)黄铜矿在空气中焙烧生成氧化铁、氧化铜和二氧化硫,反应的化学方程式为2FeCuS2+O2$\frac{\underline{\;高温\;}}{\;}$Fe2O3+4SO2+2CuO,
故答案为:2FeCuS2+O2$\frac{\underline{\;高温\;}}{\;}$Fe2O3+4SO2+2CuO;
(3)Cu2O与稀硫酸反应时既表现出氧化性又表现出还原性,亚铜离子自身氧化还原生成铜单质和铜离子,反应的离子方程式为Cu2O+2H+=Cu+Cu2++H2O,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;
(4)在铁铜的混合物中溶解铁而分离出铜,因为稀硝酸、浓硫酸都能与铜反应,所以不能用稀硝酸、浓硫酸,如果用盐酸溶解生成氯化亚铁,氯离子能被后来加入的次氯酸根氧化,所以也不能用盐酸,只能用稀硫酸,故选B;
(5)用足量Ca(OH)2悬浊液吸收形成酸雨的气体即二氧化硫,生成固体的化学式为CaSO3,然后再用硫酸处理该固体,得到的高浓度SO2用于制备硫酸,
故答案为:CaSO3;
(6)根据电子得失守恒可知,利用亚铬酸钾(KCrO2)氧化还原滴定法来确定高铁酸钾的纯度的过程中有关系式:2K2FeO4~K2Cr2O7~6(NH4)2Fe(SO4)2,滴定反应中消耗(NH4)2Fe(SO4)2的物质的量为0.01893L×0.10mol•L-1=0.001893mol,所以1.980g样品中K2FeO4的物质的量为0.001893mol÷3×$\frac{250}{25}$=0.00631mol,则上述样品中高铁酸钾的质量分数为$\frac{0.00631×198}{1.980}$×100%=63.1%,
故答案为:63.1%;
点评 本题考查了物质提纯的理解应用、实验基本操作、物质性质的分析应用、质量分数的计算等,注意离子方程式书写方法和电子得失守恒在化学计算中的应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 只能是酸 | B. | 只能是碱 | ||
| C. | 可能是酸也可能是碱 | D. | 只能是盐 |
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
| A. | 稀释浓硫酸,应将水慢慢注入盛有浓硫酸的烧杯中并搅拌 | |
| B. | 酒精灯洒出的酒精万一在桌上着火,应立即用湿抹布扑盖 | |
| C. | 碱溶液沾到皮肤上,应尽快用抹布擦拭干净,再涂上稀盐酸 | |
| D. | 氢气还原氧化铜实验结束时,为节约氢气,应先停止氢气再停止加热 |
| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |