题目内容
2.由软锰矿制备KMnO4的主要反应为:熔融氧化3MnO2+KClO3+6KOH$\stackrel{高温}{→}$3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2→2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
a.铁坩埚 b.蒸发皿 c. 瓷坩埚 d.烧杯
(2)在“加酸岐化”时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
反应后得到KMnO4的步骤是:过滤、蒸发结晶、趁热过滤.
该步骤能够得到KMnO4的原理是KMnO4和K2CO3的溶解度不同.
(3)草酸钠滴定法测定KMnO4质量分数步骤如下:
(已知涉及到的反应:Na2C2O4+H2SO4→H2C2O4(草酸)+Na2SO4
5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
Na2C2O4的式量为134 KMnO4的式量为158)
Ⅰ.称取0.80g 的KMnO4产品,配成50mL溶液.
Ⅱ.称取0.2014gNa2C2O4,置于锥形瓶中,加蒸馏水溶解,再加少量硫酸酸化.
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的KMnO4溶液滴定至终点.消耗KMnO4溶液8.48mL.
①判断达到滴定终点的标志是无色变为紫色且半分钟不褪色.
②样品中高锰酸钾的质量分数为0.700(保留3位小数).
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度偏高(填“偏高”、“偏低”或“无影响”).
分析 (1)熔融固体物质需要再坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚、铁棒、坩埚钳、泥三角、酒精灯;
(2)根据表中数据可知,K2SO4溶解度小,加硫酸时会生成K2SO4,会降低产品的纯度;盐酸具有还原性,会被氧化,降低产品的量;KMnO4和K2CO3的溶解度不同;
(3)①滴定终点,溶液颜色发生变化,且半分钟内颜色不变;
②根据反应Na2C2O4+H2SO4→H2C2O4(草酸)+Na2SO4 5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O找出关系式,然后结合题中数据计算;
③加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少.
解答 解:(1)熔融固体物质需要再坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚、铁棒、坩埚钳、泥三角、酒精灯,
故答案为:a;
(2)根据表中数据可知,K2SO4溶解度小,加硫酸时会生成K2SO4,会降低产品的纯度;盐酸具有还原性,会被氧化,降低产品的量,故不宜用盐酸,该步骤能够得到KMnO4的原理是KMnO4和K2CO3的溶解度不同,
故答案为:生成K2SO4溶解度小,会降低产品的纯度;盐酸具有还原性,会被氧化,降低产品的量;KMnO4和K2CO3的溶解度不同;
(3)①滴定终点时的现象为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色,
故答案为:无色变为紫色且半分钟不褪色;
②根据反应Na2C2O4+H2SO4→H2C2O4(草酸)+Na2SO4 5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O可得关系式:5Na2C2O4~2KMnO4,
设配制的8.48mL配制的样品溶液中含有高锰酸钾的质量为x,
则:5Na2C2O4~2KMnO4,
134×5 2×158
0.2014g x
x=$\frac{158×2×0.2014}{134×5}$=0.0950g,
50mL该样品溶液中含有高锰酸钾的质量为:0.0950g×$\frac{50ml}{8.48ml}$=0.560g,
则样品中高锰酸钾的质量分数为:$\frac{0.560g}{0.80g}$=0.700g,
故答案为:0.700;
③加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少,会导致测得产品纯度偏高,
故答案为:偏高.
点评 本题考查制备方案的设计,题目难度中等,涉及氧化还原反应离子方程式的书写、氧化还原反应滴定等知识,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.

 期末集结号系列答案
期末集结号系列答案②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
| A. | ①和②产物含有阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率越来越快 | |
| D. | 25℃.101kPa下:Na2O2(s)+2Na(s)═2Na2O(S) 放出317kJ的热量 |
| 选 项 | A | B | C | D |
| 实验操作或装置 | 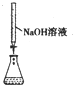 | 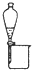 | 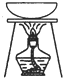 |  |
| 实验目的 | 准确量取25.00mLNaOH溶液 | 分离乙醇与乙酸乙酯 | 从KI和I2的混合物中回收I2 | 实验室制取SO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 利用地沟油制肥皂的实验中,可以用玻璃棒蘸取反应液滴入有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中的地沟油已完全皂化 | |
| B. | 制备硝基苯,混合药品的先后顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 | |
| C. | 除去溴乙烷中的少量溴:加入Na2SO3溶液,振荡,静置分层后,除去水层 | |
| D. | 实验室受酸腐蚀时的处理:先用大量水冲洗,再用饱和碳酸氢钠溶液或肥皂水洗,最后再用水冲洗 |
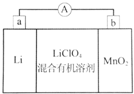 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池负极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 该电池电解液可用LiClO4水溶液代替 | |
| D. | 从废旧锂锰电池的正极材料中可回收金属Li、Mn |
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
②LiBH4由Li+和BH4-构成,BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3.
③Li、B、H元素的电负性由小到大小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为142pm,NaH的理论密度是1.37g•cm-3.[Na-23].
| 溶液中溶质质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度/(克/厘米3) | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/(克/厘米3) | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
