题目内容
20.某原子的价电子构型为3s23p2,其核外电子运动说法错误的是( )| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
分析 根据硅原子为14号元素,则核外有14种不同运动状态的电子,再根据电子排布式1s22s22p63s23p2进行分析.
解答 解:A.硅原子为14号元素,电子排布式1s22s22p63s23p2,共2种轨道,S轨道为球形只有1伸展方向,p轨道有3种伸展方向,则有4种不同的伸展方向,故A正确;
B.硅原子为14号元素,电子排布式1s22s22p63s23p2,所以有5种不同能量的电子,故B正确;
C.硅原子为14号元素,电子排布式1s22s22p63s23p2,则核外有3个电子层,所以有3种不同的运动范围,故C错误;
D.硅原子为14号元素,则核外有14种不同运动状态的电子,故D正确;
故选C.
点评 本题考查了原子的核外电子排布、轨道与能量等,题目难度不大,注意把握核外的排布规律以电子排布式的书写原理.

练习册系列答案
相关题目
15.甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 0.1mol/L甲酸溶液的c(H+)=10-3mol/L | |
| B. | 甲酸以任意比与水互溶 | |
| C. | 10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比一元强酸溶液的弱 |
5.一氧化钴(CoO)是一种重要的工业催化剂,某学习小组欲从含钴废料中(含Co2O3、CoO 和少量Fe、Al)回收一氧化钴,设计工艺流程如下:已知:Co2O3的氧化性>Cl2的氧化性下列说法不正确的是( )
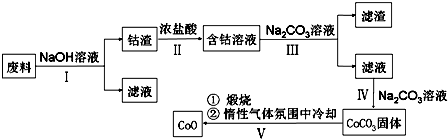

| A. | 第Ⅰ步反应后得到的滤液主要是含铝溶液 | |
| B. | 第Ⅱ步中盐酸表现出酸性、还原性,且必须过量 | |
| C. | 第Ⅲ步中Na2CO3主要作用是使Fe3+沉淀,滤渣主要为Fe(OH)3 | |
| D. | 第Ⅳ步操作为过滤,第Ⅴ步煅烧后,也可以在一氧化碳气体氛围中冷却 |
9.下列叙述正确的是( )
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
10.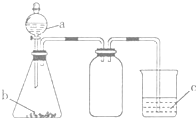 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
 .
.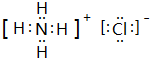 ,A2C2的电子式为
,A2C2的电子式为 .
.