题目内容
17.对于4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g),试回答有关的问题:为了提高生成SO2的速率,可以采用的措施是( )| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
分析 反应物浓度、温度、催化剂、反应物接触面积、压强(仅适用于有气体参与的反应)对化学反应速率都有影响,由此分析解答.
解答 解:反应物浓度、温度、催化剂、反应物接触面积、压强(仅适用于有气体参与的反应)对化学反应速率都有影响,要提高二氧化硫的速率,可以通过增大氧气的浓度、升高温度、增大压强来实现,而增加FeS2的量对反应速率无影响,故选BC.
点评 本题考查化学反应速率影响因素,为高频考点,明确反应速率影响因素适用范围是解本题关键,注意固体和纯液体没有浓度,为易错点.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
5.一氧化钴(CoO)是一种重要的工业催化剂,某学习小组欲从含钴废料中(含Co2O3、CoO 和少量Fe、Al)回收一氧化钴,设计工艺流程如下:已知:Co2O3的氧化性>Cl2的氧化性下列说法不正确的是( )
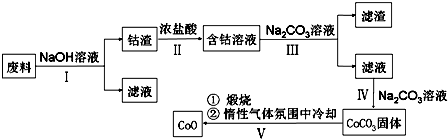

| A. | 第Ⅰ步反应后得到的滤液主要是含铝溶液 | |
| B. | 第Ⅱ步中盐酸表现出酸性、还原性,且必须过量 | |
| C. | 第Ⅲ步中Na2CO3主要作用是使Fe3+沉淀,滤渣主要为Fe(OH)3 | |
| D. | 第Ⅳ步操作为过滤,第Ⅴ步煅烧后,也可以在一氧化碳气体氛围中冷却 |
2.下列物质中,含有共价键的离子化合物的是( )
| A. | MgCl2 | B. | HCl | C. | H2O | D. | NaOH |
9.下列叙述正确的是( )
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
6.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
7.下列递变情况中,不正确的是( )
| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
 .
.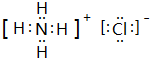 ,A2C2的电子式为
,A2C2的电子式为 .
.