题目内容
4.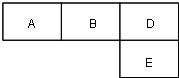 M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.
M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)写出下列元素的符号:
B:N;N:Na
(2)D、E、N形成的简单离子的半径由大到小的关系是S2->O2->Na+.(写元素符号)
(3)由D、M形成的原子个数1:1的化合物所含的化学键类型是共价键,写出该化合物的电子式
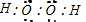 .
.
分析 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,所以M是氢气;根据A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37,且DE属于同一主族,原子序数相差8,所以A、B、D、E分别是碳元素、氮元素、氧元素、硫元素;N元素的原子半径是所在周期原子半径最大的,所以N是钠元素,由此解答.
解答 解:(1)B元素的符号:N;N元素的符号:Na,故答案为:N;Na;
(2)电子层数越多半径越大,电子层数相同核电荷数越多半径越小,O、S、Na形成的简单离子的半径由大到小的关系是S2->O2->Na+,故答案为:S2->O2->Na+;(3)由O、H形成的原子个数1:1的化合物是过氧化氢,过氧化氢中所含的化学键类型是共价键,过氧化氢的电子式 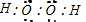 ,故答案为:共价键;
,故答案为:共价键;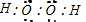 .
.
点评 本题考查了常见元素的推断,难度不大,推断时注意根据物质的性质、原子结构、元素周期律、元素的存在等知识的灵活运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.甲酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 0.1mol/L甲酸溶液的c(H+)=10-3mol/L | |
| B. | 甲酸以任意比与水互溶 | |
| C. | 10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比一元强酸溶液的弱 |
19.下列物质对应的电子式书写正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
9.下列叙述正确的是( )
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
16.在某无色透明溶液中,下列离子一定能共存的是( )
| A. | H+ Cu2+ Cl- SO42- | B. | HCO3- NO3- Na+ H+ | ||
| C. | SO42- Cl-Na+ K+ | D. | Na+SO42-H+ AlO2- |
14.化学与生活密切相关,下列说法不正确的是( )
| A. | 在汽车排气管上加装“催化转化器”可以减少有害气体的排放 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物“,PM2.5在空气中有可能形成胶体 | |
| D. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗胃酸药物使用 |
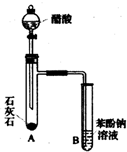 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.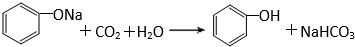 .
.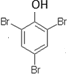 .
.