题目内容
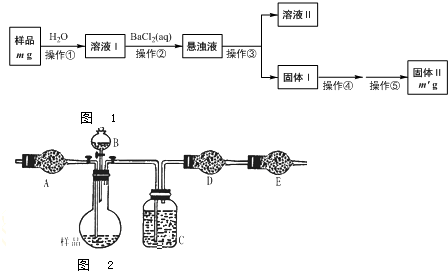
2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产的明胶作原料.这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制熬成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中.记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标.重铬酸钠俗称红矾钠(Na2Cr2O7?2H2O)是重要的化工产品和强氧化剂.工业制备的流程如下:
(1)已知Fe(CrO2)2 中铬元素是+3价,则Fe(CrO2)2 中铁元素是 价.
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3 可写成Na2O?SiO2,则Fe(CrO2 )2 可写成 .
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2 生成可溶于水的Na2CrO4,反应化学方程式如下:Fe(CrO2)2+8Na2CO3+7O2=2Fe2O2+8Na2Cr4+8CO2 为了加快该反应的反应速率,可采取的措施是 (写出一条即可).
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+=Cr2O72-+H2O; 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是 .
②混合溶液乙中溶质的化学式是 .
(5)含烙10.4%的铬铁矿100.0kg,理论上可制得红矾钠晶体(Na2Cr2O7?2H2O)多少kg?
(要求写出计算过程,结果保留1位有效数字.可能用到的相对原子质量:Fe-56,Cr-52,O-16,H-1,Na-23C-12,Na2Cr2O7?2H2O的相对分子质量为298)
(1)已知Fe(CrO2)2 中铬元素是+3价,则Fe(CrO2)2 中铁元素是
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3 可写成Na2O?SiO2,则Fe(CrO2 )2 可写成
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2 生成可溶于水的Na2CrO4,反应化学方程式如下:Fe(CrO2)2+8Na2CO3+7O2=2Fe2O2+8Na2Cr4+8CO2 为了加快该反应的反应速率,可采取的措施是
(4)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+=Cr2O72-+H2O; 3CrO42-+4H+=Cr3O102-+2H2O
①往混合溶液甲中加入硫酸必须适量的原因是
②混合溶液乙中溶质的化学式是
(5)含烙10.4%的铬铁矿100.0kg,理论上可制得红矾钠晶体(Na2Cr2O7?2H2O)多少kg?
(要求写出计算过程,结果保留1位有效数字.可能用到的相对原子质量:Fe-56,Cr-52,O-16,H-1,Na-23C-12,Na2Cr2O7?2H2O的相对分子质量为298)
考点:化学反应速率的影响因素,根据化学式判断化合价,化学方程式的有关计算
专题:关系式法,氧化还原反应专题,化学反应速率专题
分析:(1)根据正负总化合价之和相等进行分析;
(2)类比Na2SiO3可写成Na2O?SiO2完成Fe(CrO2)2的氧化物的形式;
(3)根据影响化学反应速率的因素分析;
(4)①根据流程及题中信息可知,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4;
(5)根据过程中Cr元素守恒,利用关系式法进行计算.
(2)类比Na2SiO3可写成Na2O?SiO2完成Fe(CrO2)2的氧化物的形式;
(3)根据影响化学反应速率的因素分析;
(4)①根据流程及题中信息可知,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4;
(5)根据过程中Cr元素守恒,利用关系式法进行计算.
解答:
解:(1)Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价;
故答案为:+2;
(2)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(3)增大反应物的接触面积可以加快反应速率,升高温度可以加快反应速率,
故答案为:粉碎矿石、升高温度等;
(4)①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,
故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式为Na2Cr2O7和Na2SO4,
故答案为:Na2Cr2O7和Na2SO4;
(5)根据过程中Cr元素守恒可得如下关系式:
Fe(CrO2)2 ~2Cr~Na2Cr2O7?2H2O
104g 298g
100.0kg×10.4% m(Na2Cr2O7?2H2O)
故m(Na2Cr2O7?2H2O)=100.0kg×10.4%×298g÷104g=29.8kg,
故答案为:理论上可制得红矾钠晶体29.8kg.
故答案为:+2;
(2)Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO?Cr2O3,
故答案为:FeO?Cr2O3 ;
(3)增大反应物的接触面积可以加快反应速率,升高温度可以加快反应速率,
故答案为:粉碎矿石、升高温度等;
(4)①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,
故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;
②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式为Na2Cr2O7和Na2SO4,
故答案为:Na2Cr2O7和Na2SO4;
(5)根据过程中Cr元素守恒可得如下关系式:
Fe(CrO2)2 ~2Cr~Na2Cr2O7?2H2O
104g 298g
100.0kg×10.4% m(Na2Cr2O7?2H2O)
故m(Na2Cr2O7?2H2O)=100.0kg×10.4%×298g÷104g=29.8kg,
故答案为:理论上可制得红矾钠晶体29.8kg.
点评:本题考查重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用难度较大.侧重考查学生的分析、理解等综合能力.

练习册系列答案
相关题目
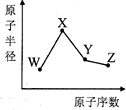 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应简单离子半径:X>W |
| B、对应气态氢化物的稳定性Y>Z |
| C、化合物XZW既含离子键,又含共价键 |
| D、Y的氧化物与Z的氧化物和X的最高价氧化物对应的水化物均能反应 |
关于物质的分类正确的是( )
| A、SO2、CO2、CO、NO2都是酸性氧化物 |
| B、Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 |
| C、HCl、HClO、HNO3、HClO4都是强酸 |
| D、NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 |
制备晶体硅的热方程式为 SiHCl3(l)+H2(g)=Si(s)+3HCl(g)△H=+238KJ/mol,
已知SiHCl3(l)=SiHCl3(g)△H=+10KJ/mol,相关键能数据如下表:则晶体硅的键能为( )
已知SiHCl3(l)=SiHCl3(g)△H=+10KJ/mol,相关键能数据如下表:则晶体硅的键能为( )
| SiHCl3(g) Si-H | SiHCl3(g) Si-Cl | H2(g) H-H | HCl(g) H-Cl | |
| 键能(KJ/mol) | 377 | 360 | 436 | 431 |
| A、186KJ/mol |
| B、181KJ/mol |
| C、372KJ/mol |
| D、362KJ/mol |
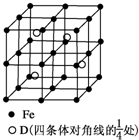 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.