题目内容
(1)甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:
CH4(g)+
O2(g)?CO(g)+2H2(g);△H=-36kJ/mol…①
CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+216kJ/mol…②
①下列说法正确的是 .
A.2H2O(l)=2H2(g)+O2(g)△H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g)=CO(g)+3H2(g).当甲烷的转化率为0.5时,此时平衡常数为 .
(2)蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH
3Na2FeO2+H2O+NH3↑…①;
8Fe+3NaNO3+5NaOH+2H2O
4Na2Fe2O4+3NH3↑…②;
以及第三步生成四氧化三铁.请补充第三步反应的方程式并配平: .
①为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: .
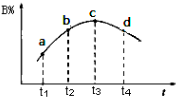
②将固体草酸锰MnC2O4?2H2O放在一个可以称出质量的容器里加热.固体质量随温度的变化关系如图所示(质量单位为g):则214℃时,剩余固体的成分为 .(填化学式);在280℃时,剩余固体的成分为 .(填化学式)

CH4(g)+
| 1 |
| 2 |
CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+216kJ/mol…②
①下列说法正确的是
A.2H2O(l)=2H2(g)+O2(g)△H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g)=CO(g)+3H2(g).当甲烷的转化率为0.5时,此时平衡常数为
(2)蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH
| ||
8Fe+3NaNO3+5NaOH+2H2O
| ||
以及第三步生成四氧化三铁.请补充第三步反应的方程式并配平:
①为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应:
②将固体草酸锰MnC2O4?2H2O放在一个可以称出质量的容器里加热.固体质量随温度的变化关系如图所示(质量单位为g):则214℃时,剩余固体的成分为

考点:用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡的计算,电解原理
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)①A.由反应②-①可计算H2O(g)=H2(g)+
O2(g)的△H,气态水的能量比液态水能量高;
B.速率之比等于化学方程式计量数之比表面的是正反应速率之比;
C.反应均为气体体积增大的反应,增大压强,平衡逆向移动;
D、维持恒定温度,吸收与放出的热量相等;
②CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 3 0 0
转化 0.5 0.5 0.5 1.5
平衡0.5 2.5 0.5 1.5
K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)由①②及生成四氧化三铁可知,Na2FeO2、Na2Fe2O4发生反应;
①在阳极上生成Al失去电子生成氧化铝;
②由图象中的数据可知,加热到50℃不发生反应,加热到100℃~214℃时发生失去结晶水的反应,质量在减少,214℃~280℃发生分解反应,根据发生的反应计算,以此来分析.
| 1 |
| 2 |
B.速率之比等于化学方程式计量数之比表面的是正反应速率之比;
C.反应均为气体体积增大的反应,增大压强,平衡逆向移动;
D、维持恒定温度,吸收与放出的热量相等;
②CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 3 0 0
转化 0.5 0.5 0.5 1.5
平衡0.5 2.5 0.5 1.5
K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)由①②及生成四氧化三铁可知,Na2FeO2、Na2Fe2O4发生反应;
①在阳极上生成Al失去电子生成氧化铝;
②由图象中的数据可知,加热到50℃不发生反应,加热到100℃~214℃时发生失去结晶水的反应,质量在减少,214℃~280℃发生分解反应,根据发生的反应计算,以此来分析.
解答:
解:(1)①A.由反应②-①可计算H2O(g)=H2(g)+
O2(g)的△H=+252kJ?mol-1,则2H2O(g)=2H2(g)+O2(g)△H=+504kJ?mol-1,气态水的能量比液态水能量高,故A错误;
B.当反应①中υ(CH4)正=υ(CO)正时,依据速率子环比等于化学方程式计量数之比,是正反应速率之比,不能表明该反应达平衡状态,故B错误;
C.反应均为气体体积增大的反应,增大压强,平衡逆向移动,所以反应①②中甲烷的转化率均减小,故C错误;
D、维持恒定温度,吸收与放出的热量相等,则反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为
=6:1,故D正确;
故答案为:D;
②CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 3 0 0
转化 0.5 0.5 0.5 1.5
平衡 0.5 2.5 0.5 1.5
K=
=1.35;
故答案为:1.35;
(2)由①②及生成四氧化三铁可知,Na2FeO2、Na2Fe2O4发生反应,该反应为Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH,
故答案为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH;
①在阳极上生成Al失去电子生成氧化铝,阳极电极反应为3H2O+2Al-6e-=Al2O3+6H+,
故答案为:3H2O+2Al-6e-=Al2O3+6H+;
②MnC2O4?2H2O
MnC2O4+2H2O
179 143
1.000g x
解得x≈0.8g,
则214℃时,结晶水已全部失去,剩余固体的成分为MnC2O4,
280℃时,由固体质量在减小,则草酸锰分解生成的是氧化锰和一氧化碳、二氧化碳,
MnC2O4
MnO+CO2↑+CO↑
143 71
0.8g y
解得y≈0.4g,
则280℃时分解完全,剩余固体的成分为MnO;
故答案为:MnC2O4;MnO.
| 1 |
| 2 |
B.当反应①中υ(CH4)正=υ(CO)正时,依据速率子环比等于化学方程式计量数之比,是正反应速率之比,不能表明该反应达平衡状态,故B错误;
C.反应均为气体体积增大的反应,增大压强,平衡逆向移动,所以反应①②中甲烷的转化率均减小,故C错误;
D、维持恒定温度,吸收与放出的热量相等,则反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为
| 216 |
| 36 |
故答案为:D;
②CH4(g)+H2O(g)?CO(g)+3H2(g)
开始 1 3 0 0
转化 0.5 0.5 0.5 1.5
平衡 0.5 2.5 0.5 1.5
K=
| 0.5×1.53 |
| 0.5×2.5 |
故答案为:1.35;
(2)由①②及生成四氧化三铁可知,Na2FeO2、Na2Fe2O4发生反应,该反应为Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH,
故答案为:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH;
①在阳极上生成Al失去电子生成氧化铝,阳极电极反应为3H2O+2Al-6e-=Al2O3+6H+,
故答案为:3H2O+2Al-6e-=Al2O3+6H+;
②MnC2O4?2H2O
| ||
179 143
1.000g x
解得x≈0.8g,
则214℃时,结晶水已全部失去,剩余固体的成分为MnC2O4,
280℃时,由固体质量在减小,则草酸锰分解生成的是氧化锰和一氧化碳、二氧化碳,
MnC2O4
| ||
143 71
0.8g y
解得y≈0.4g,
则280℃时分解完全,剩余固体的成分为MnO;
故答案为:MnC2O4;MnO.
点评:本题考查了反应热的计算、平衡状态的判断、K的有关计算、根据方程式的计算等,侧重于考查学生对基础知识的综合应用能力和计算能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通的肥皂洗涤时,会发现黄色污渍变为红色,经水漂洗后红色又变黄色.据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用( )
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
下列实验方案设计正确的是( )
| A、分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B、失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 |
| C、将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D、检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
生活中碰到的某些问题,常涉及到化学知识,下列分析不正确的是( )
| A、医疗上常用体积分数为70%~75%的酒精作消毒剂 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
| C、某酸雨样品采集后放置一段时间,pH值变小,是因为水中又溶解了较多的CO2 |
| D、为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 |