题目内容
 A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.
A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子.(1)A、C形成的化合物
①一定属于离子化合物 ②一定属于共价化合物 ③可能属于离子化合物,也可能属于共价化合物
(2)C原子的电子排布式为
(3)若A元素的原子最外层电子排布为1s1,写出A、C形成的含有配位键的一种微粒符号:
(4)当n=2时,每个BC2中含有
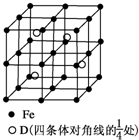
(5)若D元素与Fe形成某种晶体,该晶体的晶胞如图所示.则该晶体的化学式是
考点:晶胞的计算,位置结构性质的相互关系应用
专题:
分析:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有1个电子,则D元素原子电子排布式为1s22s22p6 3s23p1,故D为Al元素,
(1)A位于ⅠA族,可能为H,也可能为Na,可于O反应生成共价化合物或离子混合物;
(2)C为O元素,根据核外电子排布规律书写;
(3)若A元素的原子最外层电子排布为1s1,为H元素,与O可形成H3O+,含有配位键;
(4)当n=2时,B为C元素,CO2的结构式为O=C=O;
(5)晶胞中含有4个Al原子,根据均摊法计算晶胞中Fe原子数目,据此确定该晶体的化学式;
计算晶胞的质量与体积,根据ρ=
计算晶胞的密度.
(1)A位于ⅠA族,可能为H,也可能为Na,可于O反应生成共价化合物或离子混合物;
(2)C为O元素,根据核外电子排布规律书写;
(3)若A元素的原子最外层电子排布为1s1,为H元素,与O可形成H3O+,含有配位键;
(4)当n=2时,B为C元素,CO2的结构式为O=C=O;
(5)晶胞中含有4个Al原子,根据均摊法计算晶胞中Fe原子数目,据此确定该晶体的化学式;
计算晶胞的质量与体积,根据ρ=
| m |
| V |
解答:
解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有1个电子,则D元素原子电子排布式为1s22s22p6 3s23p1,故D为Al元素,
(1)A位于ⅠA族,可能为H,也可能为Na,可于O反应生成共价化合物或离子混合物,故答案为:③;
(2)氧原子核外电子数为8,核外电子排布为1s22s22p4,故答案为:1s22s22p4;
(3)若A元素的原子最外层电子排布为1s1,为H元素,与O可形成H3O+,含有配位键,故答案为:H3O+;
(4)当n=2时,B为C元素,CO2的结构式为O=C=O,含有2个π键,故答案为:2;
(5)晶胞中含有4个Al原子,晶胞中Fe原子数目=1+8×
+6×
+12×
=8,Fe与Al原子数目之比为2:1,故该晶体的化学式为Fe2Al;
晶胞的质量=4×
g,晶胞的边长为a nm,则晶胞体积=(a×10-7 cm)3=a3×10-21 cm3,故晶胞的密度=
=
g/cm3,
故答案为:Fe2Al;
.
(1)A位于ⅠA族,可能为H,也可能为Na,可于O反应生成共价化合物或离子混合物,故答案为:③;
(2)氧原子核外电子数为8,核外电子排布为1s22s22p4,故答案为:1s22s22p4;
(3)若A元素的原子最外层电子排布为1s1,为H元素,与O可形成H3O+,含有配位键,故答案为:H3O+;
(4)当n=2时,B为C元素,CO2的结构式为O=C=O,含有2个π键,故答案为:2;
(5)晶胞中含有4个Al原子,晶胞中Fe原子数目=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
晶胞的质量=4×
| 139 |
| NA |
4×
| ||
| a3×10-21 cm3 |
| 5.56×1023 |
| a3NA |
故答案为:Fe2Al;
| 5.56×1023 |
| a3NA |
点评:本题是对物质结构与性质的考查,为高频考点,侧重于学生的分析能力和计算能力的考查,本题涉及结构性质位置关系、核外电子排布、晶体类型、化学键、晶胞计算等,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
标准状况下,两种气体的体积相等,则( )
| A、所含原子数一定相等 |
| B、物质的量一定相等 |
| C、质量一定相等 |
| D、密度一定相等 |
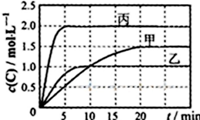 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).